Đề thi thử Tốt nghiệp THPT năm 2025 môn Hóa học Sở GD&ĐT Hải Phòng - Đề 4
28 câu hỏi 60 phút
Hình vẽ dưới đây minh hoạ cho thí nghiệm về ăn mòn kim loại mà một học sinh thực hiện:
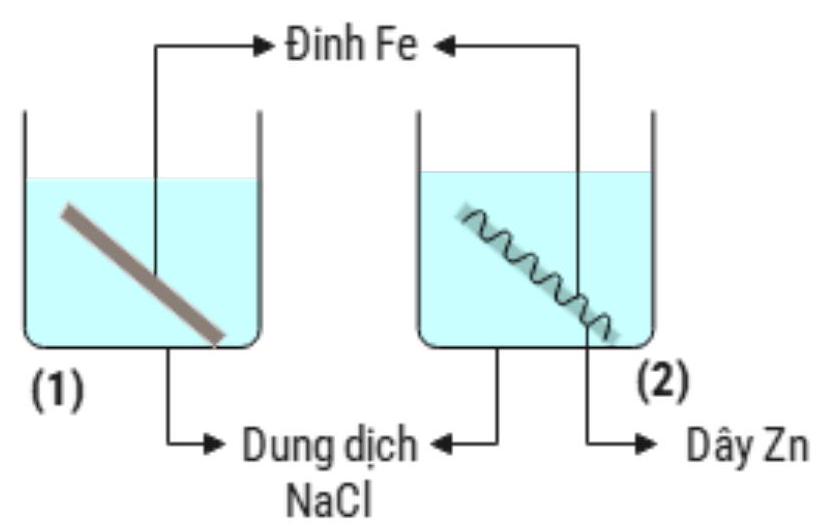 Để yên hai cốc sau một thời gian (cho biết là đinh Fe làm bằng thép). Nhận định nào sau đây đúng?
Để yên hai cốc sau một thời gian (cho biết là đinh Fe làm bằng thép). Nhận định nào sau đây đúng?
Ở cốc (1) nếu thay đinh sắt bằng hợp kim\(\mathrm{Fe}-\mathrm{Cu}\) thì Cu sẽ bị ăn mòn trước
Ở cốc (2) Zn và Fe đều không bị ăn mòn
Ở cốc (1) Fe không bị ăn mòn
Ở cốc (2) Zn bị ăn mòn trước, khi Zn bị ăn mòn hết thì Fe sẽ bị ăn mòn
C. Sai vì đinh sắt là hợp kim do đó khi tiếp xúc dung dịch NaCl thì vẫn bị ăn mòn điện hóa
Danh sách câu hỏi:
C. Sai vì đinh sắt là hợp kim do đó khi tiếp xúc dung dịch NaCl thì vẫn bị ăn mòn điện hóa
Thạch cao có thành phần chính là\(\mathrm{CaSO}_{4}\).
Câu 4:
Phát biểu nào sau đây sai?
Câu 7:
Chất nào sau đây có thể làm thuốc trừ sâu, thường dùng để phun trị bệnh nấm mốc sương cho nho?
Câu 11:
Cho các nguyên tố có vị trí trong bảng tuần hoàn như hình dưới đây?
Phát biểu nào sau đây là ĐÚNG?
Câu 19:
Giải Nobel Hóa học năm 2022 được trao cho các nhà khoa học nghiên cứu về hóa học click". Hợp chất \(\mathrm{DBCO}-\mathrm{Acid}\) dưới đây là phân tử được sử dụng trong nghiên cứu này.
Cho các phát biểu sau:
DBCO-acid có thể tham gia phản ứng cộng
DBCO-acid có thể phản ứng với NaOH vời tỷ lệ tối đa là \(1: 1\)
DBCO -acid có thể làm mất màu dung dịch nước bromine và dung dịch \(\mathrm{KMnO}_{4}\) trong môi trường acid
DBCO-acid có thể phản ứng với amino acid và nhóm amine trong protein ở điều kiện thích hợp
Câu 20:
Cho phản ứng như sau: \(\mathrm{aA} \longrightarrow \mathrm{bB}\). Kết quả sự thay đổi số mol theo thời gian được mô tả bằng hình vẽ sau:
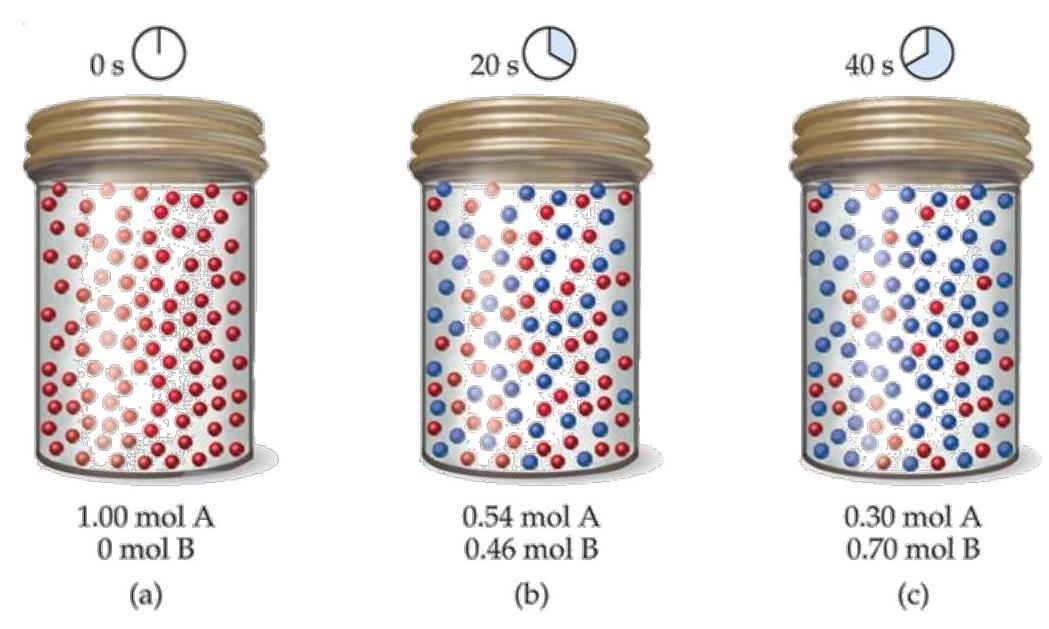 Cho các phát biểu sau:
Cho các phát biểu sau:
Tỷ lệ hệ số cân bằng \(a\) và \(b\) là \(1: 1\)
Tốc độ phản ứng trong 20 s đầu là \(0,023 \mathrm{~mol} / \mathrm{s}\)
Tốc độ tiêu hao chất A và tốc độ hình thành chất B là bằng nhau trong 40 s đầu của phản ứng
Tốc độ hình thành chất B trong 40 s là \(0,0175 \mathrm{~mol} / \mathrm{s}\)
Câu 21:
Người ta thường dùng ethyl acohol để lên men tạo acetic acid. Để xác định hàm lượng acetic acid trong giấm, người ta cho các cách dưới đây:
Cách 1: Xác định khối lượng riêng của giấm rồi so với khối lượng riêng của dung dịch mẫu pha từ \(\mathrm{CH}_{3} \mathrm{COOH}\) và nước.
Cách 2: Cô cạn nước, còn lại là \(\mathrm{CH}_{3} \mathrm{COOH}\).
Cách 3: Chuẩn độ bằng dung dịch NaOH đã biết nồng độ tới khi làm dung dịch phenolphthalein hóa hồng.
Cho các phát biểu sau:
Phản ứng lên men tạo acetic acid từ ethyl alcohol là \(\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}+\mathrm{O}_{2} \xrightarrow{\text { men }} \mathrm{CH}_{3} \mathrm{COOH}+\mathrm{H}_{2} \mathrm{O}\)
Cách (1), (3) đều có thể dùng để xác định hàm lượng acetic acid trong giấm
Cách (2) sai vì khi cô cạn thì \(\mathrm{CH}_{3} \mathrm{COOH}\) kết tinh ở chất rắn dạng ngậm nước
Nếu \(\mathrm{H} \%=50 \%\) thì từ 46 gam \(\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}\) điều chế được dung dịch có chứa 23,0 gam \(\mathrm{CH}_{3} \mathrm{COOH}\)
Câu 22:
Trước đây, tinh thể copper(II) sulfate được "nuôi" như sau:
Bước 1: Cho dung dịch sulfuric acid loãng vào cốc thuỷ tinh.
Bước 2: Đun nóng dung dịch acid.
Bước 3: Thêm copper (II) oxide vào đến dư.
Bước 4: Đợi phản ứng xảy ra hoàn toàn rồi lọc hỗn hợp thu được.
Bước 5: Làm bay hơi nước lọc cho đến khi tinh thể xuất hiện trong cốc.
Bước 6: Làm mát cốc nước lọc.
Cho các phát biểu sau:
Mục đích của bước 3 là để chắc chắn sulfuric acid phản ứng hết
Mục đích của bước 4 là để thu copper(II) sulfate rắn
Tinh thế copper(II) sulfate là dạng rắn kết tinh màu xanh
Cho 50 gam tinh thể \(\mathrm{CuSO}_{4} \cdot \mathrm{nH}_{2} \mathrm{O}\) vào 450 ml nước, thu được dung dịch A . Sau đó cho vừa đủ dung dịch NaOH vào dung dịch A , sau khi phản ứng kết thúc thu được 19,6 gam kết tủa. Công thức của tinh thể xác định được là \(\mathrm{CuSO}_{4} .3 \mathrm{H}_{2} \mathrm{O}\)