Câu hỏi:
Chất nào sau đây không tạo được liên kết hydrogen giữa các phân tử?
Đáp án đúng: D
Câu hỏi này thuộc đề thi trắc nghiệm dưới đây, bấm vào Bắt đầu thi để làm toàn bài
Tuyển Tập Đề Thi Tham Khảo Tốt Nghiệp THPT Năm 2025 – Hóa Học – Bộ Đề 03 là tài liệu ôn tập quan trọng dành cho học sinh lớp 12, giúp các em rèn luyện kỹ năng làm bài và chuẩn bị tốt nhất cho kỳ thi tốt nghiệp THPT 2025. Bộ đề được biên soạn theo định hướng của Bộ GD ĐT, bám sát chương trình học, bao gồm các chủ đề trọng tâm như phản ứng oxi hóa - khử, điện hóa học, este – chất béo, amino axit – protein, kim loại và phi kim… Hệ thống câu hỏi trắc nghiệm đa dạng, được thiết kế theo nhiều mức độ từ nhận biết, thông hiểu đến vận dụng và vận dụng cao, giúp học sinh làm quen với cấu trúc đề thi và phát triển tư duy hóa học. Mỗi đề thi đều có đáp án chi tiết và hướng dẫn giải cụ thể, hỗ trợ học sinh tự đánh giá năng lực, xác định điểm mạnh và cải thiện điểm yếu trong quá trình ôn tập.
Câu hỏi liên quan
Phát biểu đúng là (a) và (e).
Giải Nobel Hóa học năm 2022 được trao cho các nhà khoa học nghiên cứu về hóa học click". Hợp chất \(\mathrm{DBCO}-\mathrm{Acid}\) dưới đây là phân tử được sử dụng trong nghiên cứu này.
Cho các phát biểu sau:
DBCO-acid có thể tham gia phản ứng cộng
DBCO-acid có thể phản ứng với NaOH vời tỷ lệ tối đa là \(1: 1\)
DBCO -acid có thể làm mất màu dung dịch nước bromine và dung dịch \(\mathrm{KMnO}_{4}\) trong môi trường acid
DBCO-acid có thể phản ứng với amino acid và nhóm amine trong protein ở điều kiện thích hợp
a. Đúng vì DBCO-acid chứa vòng benzene và chứa liên kết ba carbon-carbon có thể tham gia phản ứng cộng với hydro nên chất này có tham gia phản ứng cộng.
b. Sai vì \(\mathrm{DBCO}-\mathrm{acid}\) chứa nhóm carboxyl \((\mathrm{COOH})\) và nhôm amide \((\mathrm{C}(=\mathrm{O}) \mathrm{N}-\mathrm{X})\) và do đó 1 mol chất này phản ứng được với nhiều nhất 2 mol NaOH.
c. Đúng vì DBCO -acid chứa liên kết ba carbon-carbon nên có thể bị oxi hóa bởi dung dịch nước brom và \(\mathrm{KMnO}_{4}\) trong môi trường acid \(\rightarrow\) Dung dịch nhạt dần.
d. Đúng vì \(\mathrm{DBCO}-\mathrm{acid}\) chứa nhóm carboxyl nên có thể phản ứng với amino acid và nhóm amine trong protein.
Cho phản ứng như sau: \(\mathrm{aA} \longrightarrow \mathrm{bB}\). Kết quả sự thay đổi số mol theo thời gian được mô tả bằng hình vẽ sau:
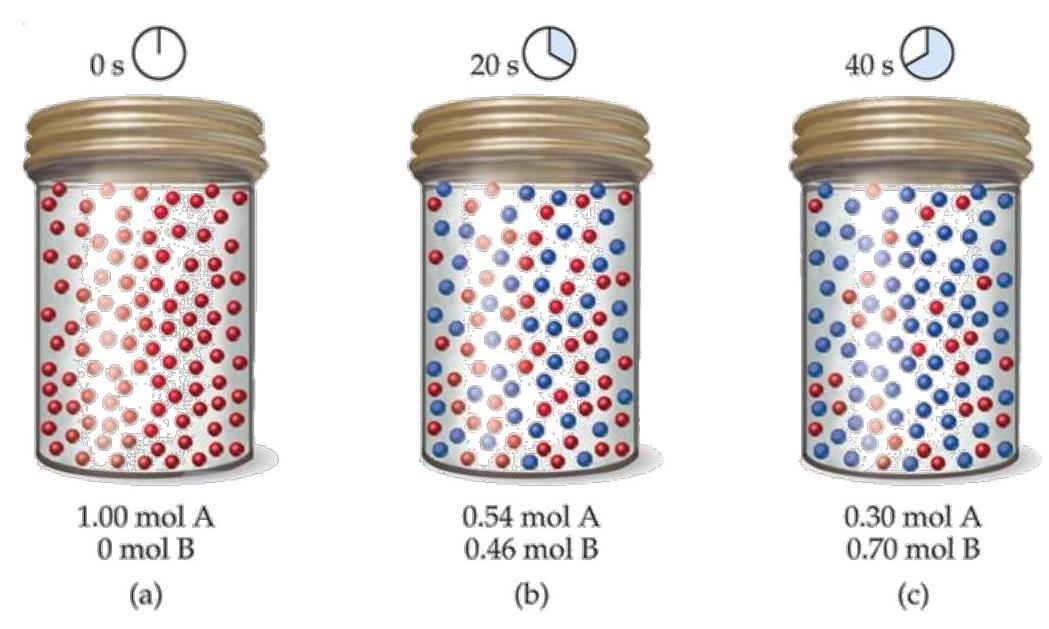 Cho các phát biểu sau:
Cho các phát biểu sau:
Tỷ lệ hệ số cân bằng \(a\) và \(b\) là \(1: 1\)
Tốc độ phản ứng trong 20 s đầu là \(0,023 \mathrm{~mol} / \mathrm{s}\)
Tốc độ tiêu hao chất A và tốc độ hình thành chất B là bằng nhau trong 40 s đầu của phản ứng
Tốc độ hình thành chất B trong 40 s là \(0,0175 \mathrm{~mol} / \mathrm{s}\)
Bước 1. Xác định dữ kiện ban đầu: phương trình, tỷ lệ phản ứng, nồng độ ban đầu.
Theo dữ kiện từ hình vẽ thì ta có:
- Tại \(t=0\) : A là chất tham gia, B là chất sản phẩm (vì nồng độ B tăng theo thời gian và nồng độ A giảm dần theo thời gian)
- Số mol ban đầu của A là \(\mathrm{n}_{\mathrm{bdA}}=1 \mathrm{~mol}\)
- Xét từ \(0 \mathrm{~s}-20 \mathrm{~s}\) thì số mol A tham gia \(=\) số mol B sinh ra.
Từ \(20 \mathrm{~s}-40 \mathrm{~s}\) cũng có điều tương tự.
Do đó phương trình phản ứng và tỷ lệ phản ứng như sau: \(A \longrightarrow B\)
a. Đúng.
b. Đúng vì trong 20 s đầu thì tốc độ phản ứng bằng tốc độ tiêu hao của A là
\(\overline{\mathrm{v}}=-\frac{\Delta \mathrm{C}_{\mathrm{A}}}{\Delta \mathrm{t}}=-\frac{0,54-1}{20-0}=0,023 \mathrm{mols}^{-1}\)
c. Đúng vì tỷ lệ phản ứng A và B là \(1: 1\).
d. Đúng vì tốc độ tạo thành của \(B\) trong khoảng \(0 \mathrm{~s}-40 \mathrm{~s}\) là \(\bar{v}=\frac{\Delta C_{B}}{\Delta t}=\frac{0,70-0,00}{40-0}=0,0175 \mathrm{mols}^{-1}\).
Người ta thường dùng ethyl acohol để lên men tạo acetic acid. Để xác định hàm lượng acetic acid trong giấm, người ta cho các cách dưới đây:
Cách 1: Xác định khối lượng riêng của giấm rồi so với khối lượng riêng của dung dịch mẫu pha từ \(\mathrm{CH}_{3} \mathrm{COOH}\) và nước.
Cách 2: Cô cạn nước, còn lại là \(\mathrm{CH}_{3} \mathrm{COOH}\).
Cách 3: Chuẩn độ bằng dung dịch NaOH đã biết nồng độ tới khi làm dung dịch phenolphthalein hóa hồng.
Cho các phát biểu sau:
Phản ứng lên men tạo acetic acid từ ethyl alcohol là \(\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}+\mathrm{O}_{2} \xrightarrow{\text { men }} \mathrm{CH}_{3} \mathrm{COOH}+\mathrm{H}_{2} \mathrm{O}\)
Cách (1), (3) đều có thể dùng để xác định hàm lượng acetic acid trong giấm
Cách (2) sai vì khi cô cạn thì \(\mathrm{CH}_{3} \mathrm{COOH}\) kết tinh ở chất rắn dạng ngậm nước
Nếu \(\mathrm{H} \%=50 \%\) thì từ 46 gam \(\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}\) điều chế được dung dịch có chứa 23,0 gam \(\mathrm{CH}_{3} \mathrm{COOH}\)
a. Đúng
b. Sai vì
- Cách 1: Hỗn hợp còn ethanol, \(\mathrm{H}_{2} \mathrm{O}\) tuỳ vào tỷ lệ của nguyên liệu sản xuất.
- Cách 3: là cách hay dùng nhất.
c. Sai vì nhiệt độ sôi của acetic acid gần với \(\mathrm{H}_{2} \mathrm{O}\).
d. Sai vì
Ta có : \(\left\{\begin{array}{l}n_{\text {ethanol }}=\frac{46}{46}=1 \mathrm{~mol} \\ n_{\text {aceticacid }}=\frac{23}{60} \mathrm{~mol}\end{array} \Rightarrow n_{\text {ethanolthamgian }} \Rightarrow \frac{23}{60} \Rightarrow H \%=\frac{\frac{23}{60}}{1} \cdot 100=38,33 \%\right.\)
Trước đây, tinh thể copper(II) sulfate được "nuôi" như sau:
Bước 1: Cho dung dịch sulfuric acid loãng vào cốc thuỷ tinh.
Bước 2: Đun nóng dung dịch acid.
Bước 3: Thêm copper (II) oxide vào đến dư.
Bước 4: Đợi phản ứng xảy ra hoàn toàn rồi lọc hỗn hợp thu được.
Bước 5: Làm bay hơi nước lọc cho đến khi tinh thể xuất hiện trong cốc.
Bước 6: Làm mát cốc nước lọc.
Cho các phát biểu sau:
Mục đích của bước 3 là để chắc chắn sulfuric acid phản ứng hết
Mục đích của bước 4 là để thu copper(II) sulfate rắn
Tinh thế copper(II) sulfate là dạng rắn kết tinh màu xanh
Cho 50 gam tinh thể \(\mathrm{CuSO}_{4} \cdot \mathrm{nH}_{2} \mathrm{O}\) vào 450 ml nước, thu được dung dịch A . Sau đó cho vừa đủ dung dịch NaOH vào dung dịch A , sau khi phản ứng kết thúc thu được 19,6 gam kết tủa. Công thức của tinh thể xác định được là \(\mathrm{CuSO}_{4} .3 \mathrm{H}_{2} \mathrm{O}\)
a. Đúng vì thêm CuO dư thì \(\mathrm{H}_{2} \mathrm{SO}_{4}\) sẽ tham gia phản ứng hết.
b. Sai vì mục đích của bước 4 là loại bỏ CuO còn dư.
c. Đúng vì tinh thể \(\mathrm{CuSO}_{4} . \mathrm{nH}_{2} \mathrm{O}\) có màu xanh.
d. Sai vì
Phương trình phản ứng: \(\mathrm{CuSO}_{4}+\mathrm{NaOH} \longrightarrow \mathrm{Cu}(\mathrm{OH})_{2}+\mathrm{Na}_{2} \mathrm{SO}_{4}\).
Ta có: \(\mathrm{n}_{\mathrm{Cu}(\mathrm{OH})_{2} \downarrow}=\frac{19,6}{98}=0,2 \xrightarrow{\text { BTNTCu }} \mathrm{n}_{\mathrm{CuSO}_{4} \cdot \mathrm{HH}_{2} \mathrm{O}}=0,2\).
Theo đề: \(0,2=\frac{50}{160+18 n} \Rightarrow n=5 \xrightarrow{\mathrm{CT}} \mathrm{CuSO}_{4} \cdot 5 \mathrm{H}_{2} \mathrm{O}\)

Bộ 50 Đề Thi Thử Tốt Nghiệp THPT Giáo Dục Kinh Tế Và Pháp Luật Năm 2026 – Theo Cấu Trúc Đề Minh Họa Bộ GD&ĐT

Bộ 50 Đề Thi Thử Tốt Nghiệp THPT Lịch Sử Học Năm 2026 – Theo Cấu Trúc Đề Minh Họa Bộ GD&ĐT

Bộ 50 Đề Thi Thử Tốt Nghiệp THPT Công Nghệ Năm 2026 – Theo Cấu Trúc Đề Minh Họa Bộ GD&ĐT

Bộ 50 Đề Thi Thử Tốt Nghiệp THPT Môn Hóa Học Năm 2026 – Theo Cấu Trúc Đề Minh Họa Bộ GD&ĐT

Bộ 50 Đề Thi Thử Tốt Nghiệp THPT Môn Sinh Học Năm 2026 – Theo Cấu Trúc Đề Minh Họa Bộ GD&ĐT

Bộ 50 Đề Thi Thử Tốt Nghiệp THPT Môn Vật Lí Năm 2026 – Theo Cấu Trúc Đề Minh Họa Bộ GD&ĐT
ĐĂNG KÝ GÓI THI VIP
- Truy cập hơn 100K đề thi thử và chính thức các năm
- 2M câu hỏi theo các mức độ: Nhận biết – Thông hiểu – Vận dụng
- Học nhanh với 10K Flashcard Tiếng Anh theo bộ sách và chủ đề
- Đầy đủ: Mầm non – Phổ thông (K12) – Đại học – Người đi làm
- Tải toàn bộ tài liệu trên TaiLieu.VN
- Loại bỏ quảng cáo để tăng khả năng tập trung ôn luyện
- Tặng 15 ngày khi đăng ký gói 3 tháng, 30 ngày với gói 6 tháng và 60 ngày với gói 12 tháng.