Trắc nghiệm Cân bằng hóa học Hóa Học Lớp 10
-
Câu 1:
Cho cân bằng trong bình kín: N2 (k) + 3H2 (k) ⇆ 2NH3 (k)
Khi tăng nhiệt độ thì số mol hỗn hợp khí tăng. Phát biểu đúng về cân bằng này là
A. Phản ứng nghịch thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Phản ứng thuận thu nhiệt, cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
C. Phản ứng nghịch tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ
D. Phản ứng thuận tỏa nhiệt, cân bằng chuyển dịch theo chiều nghịch khi tăng nhiệt độ
-
Câu 2:
Khi tăng áp suất chung của hệ thì cân bằng nào sau đây chuyển dịch theo chiều nghịch (giữ nguyên các yếu tố khác)?
A. CO2 (k) + H2 (k) ⇆ CO(k) + H2O(k)
B. N2O4 (k) ⇆ 2NO2 (k)
C. 2SO2 (k) + O2 (k) ⇆ 2SO3 (k).
D. N2 (k) + 3H2 (k) ⇆ 2NH3 (k)
-
Câu 3:
Cho cân bằng hóa học: 2SO2(k) + O2(k) ⇔ 2SO3(k); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2
-
Câu 4:
Cho cân bằng hoá học sau: 2NH3 (k) ⇆ N2 (k) + 3H2 (k). Khi tăng nhiệt độ của hệ thì tỉ khối của hỗn hợp so với hiđro giảm. Nhận xét nào sau đây là đúng?
A. Khi tăng nồng độ của NH3, cân bằng chuyển dịch theo chiều nghịch.
B. Phản ứng thuận là phản ứng toả nhiệt.
C. Khi tăng áp suất của hệ, cân bằng chuyển dịch theo chiều thuận.
D. Khi tăng nhiệt độ của hệ, cân bằng chuyển dịch theo chiều thuận
-
Câu 5:
Cho cân bằng hoá học: N2(k) + 3H2(k) ⇆ 2NH3(k) (∆H > 0)
Cân bằng trên chuyển dịch theo chiều thuận khi
A. Khi tăng áp suất của hệ → Cân bằng sẽ chuyển dịch theo chiều giảm áp suất tức là chiều giảm số phân tử khí → Chiều thuận
B. Khi tăng nhiệt độ của hệ → Cân bằng sẽ chuyển dịch theo chiều giảm nhiệt độ tức là chiều thu nhiệt → Chiều nghịch (Do phản ứng theo chiều thuận là phản ứng tỏa nhiệt)
C. Khi giảm áp suất của hệ → Cân bằng sẽ chuyển dịch theo chiều tăng áp suất tức là chiều tăng số phân tử khí → Chiều nghịch
D. Khi thêm chất xúc tác vào hệ thì cân bằng không chuyển dịch mà chỉ làm phản ứng nhanh đạt trạng thái cân bằng
-
Câu 6:
Cho cân bằng sau diễn ra trong hệ kín:
2NO2 (k) ⇆ N2O4 (k)
Nâu đỏ không màu
Biết rằng khi làm lạnh thấy màu của hỗn hợp khí nhạt hơn. Các yếu tố tác động vào hệ cân bằng trên đều làm cho cân bằng hóa học chuyển dịch theo chiều nghịch là
A. tăng nhiệt độ và tăng áp suất chung của hệ phản ứng
B. giảm nhiệt độ và giảm áp suất chung của hệ phản ứng.
C. tăng nhiệt độ và giảm áp suất chung của hệ phản ứng.
D. tăng nhiệt độ và cho thêm chất xúc tác.
-
Câu 7:
Cho cân bằng hóa học: H2 (k) + I2 (k) ⇆ 2HI (k) (∆H > 0)
Cân bằng không bị chuyển dịch khi:
A. giảm nồng độ HI
B. tăng nồng độ H2
C. tăng nhiệt độ của hệ
D. giảm áp suất chung của hệ
-
Câu 8:
Cho cân bằng sau diễn ra trong hệ kín:
2NO2 (k) ⇆ N2O4 (k)
Nâu đỏ không màu
Biết rằng khi làm lạnh thấy màu của hỗn hợp khí nhạt hơn. Các yếu tố tác động vào hệ cân bằng trên đều làm cho cân bằng hóa học chuyển dịch theo chiều nghịch là
A. tăng nhiệt độ và tăng áp suất chung của hệ phản ứng.
B. giảm nhiệt độ và giảm áp suất chung của hệ phản ứng.
C. tăng nhiệt độ và giảm áp suất chung của hệ phản ứng.
D. tăng nhiệt độ và cho thêm chất xúc tác.
-
Câu 9:
Cho các cân bằng hóa học:
N2 (k) + 3H2 (k) ⇆ 2NH3 (k) (1)
H2 (k) + I2 (k) ⇆ 2HI (k) (2)
2SO2 (k) + O2 (k) ⇆ 2SO3 (k) (3)
2NO2 (k) ⇆ N2O4 (k) (4)
Khi thay đổi áp suất những cân bằng hóa học nào bị chuyển dịch?
A. 1), (2), (3)
B. (1), (2), (4)
C. (1), (3), (4)
D. (2), (3), (4)
-
Câu 10:
Cho các phát biểu sau về cân bằng hóa học: (1) Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. (2) Ở trạng thái cân bằng hóa học, phản ứng dừng lại. (3) Trong hệ đạt trạng thái cân bằng hóa học, luôn có mặt của các chất sản phầm, các chất phản ứng có thể không có. (4) Ở trạng thái cân bằng hóa học, nồng độ các chất phản ứng giảm đi bao nhiêu theo phản ứng thuận lại được tạo ra bấy nhiêu theo phản ứng nghịch. (5) Trong tất cả các cân bằng hóa học trong pha khí, khi thay đổi áp suất của hệ, cân bằng bị chuyển dịch. Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
-
Câu 11:
Cho H2(k) + I2(k) ⇋ 2HI(k). Hỏi tốc độ của phản ứng sẽ tăng mấy lần khi tăng áp suất chung của hệ lên 3 lần?
A. 3
B. 6
C. 9
D. 12
-
Câu 12:
Cho 2NO(k) + O2(k) → 2NO2(k), tốc độ phản ứng được tính y = k [NO]2[O2]. Áp suất chung của hệ đã tăng bao nhiêu lần khi tốc độ của phản ứng tăng 64 lần biết nhiệt độ không đổi?
A. 2
B. 3
C. 4
D. 5
-
Câu 13:
Phát biểu nào trong 4 phát biểu về chất xúc tác không đúng?
A. Chất xúc tác làm tăng tốc độ phản ứng
B. Chất xúc tác làm giảm thời gian đạt tới cân bằng của phản ứng
C. Chất xúc tác được hoàn nguyên sau phản ứng
D. Chất xúc làm cho phản ứng dịch chuyển theo chiều thuận.
-
Câu 14:
Để cân bằng dịch chuyển sang chiều thuận trong A2(k) + B2(k) ⇋ 2AB(k); ΔH > 0?
A. Tăng nhiệt độ, giảm áp suất
B. Tăng nhiệt độ, giữ nguyên áp suất
C. Giảm nhiệt độ, tăng áp suất
D. Nhiệt độ và áp suất đều tăng
-
Câu 15:
Dưới tác dụng của nhiệt, PCl5 bị phân tách thành PCl3 và Cl2 theo phản ứng cân bằng PCl5 (k) ⇔ PCl3 (k) + Cl2 (k). Ở 2730C và dưới áp suất 1atm, hỗn hợp lúc cân bằng có khối lượng riêng là 2,48 gam/lít. Lúc cân bằng nồng độ mol của PCl5 có giá trị gần nhất với ?
A. 0,75.10-3
B. 1,39.10-3
C. 1,45.10-3
D. 1,98.10-3
-
Câu 16:
Từ phản ứng nX (k) + mY (k) pZ (k) + qT (k). Ở 50oC, số mol chất Z là x; Ở 100oC số mol chất Z là y. Biết x > y và (n+m) > (p+q), kết luận nào sau đây đúng?
A. Phản ứng thuận thu nhiệt, làm tăng áp suất của hệ.
B. Phản ứng thuận tỏa nhiệt, làm tăng áp suất của hệ.
C. Phản ứng thuận thu nhiệt, làm giảm áp suất của hệ.
D. Phản ứng thuận tỏa nhiệt, làm giảm áp suất của hệ.
-
Câu 17:
Tính hằng số cân bằng KC ở toC của phản ứng biết một bình phản ứng có dung tích không đổi, chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở toC, H2 chiếm 50% thể tích hỗn hợp thu được.
A. 2,500
B. 3,125
C. 0,609
D. 0,500.
-
Câu 18:
Từ phản ứng 2SO2 + O2 ⇔ 2SO3 tính hằng số cân bằng của phản ứng biết nồng độ ban đầu của SO2 và O2 tương ứng là 4 mol/l và 2 mol/l. Khi cân bằng, có 80% SO2 đã phản ứng
A. 40
B. 30
C. 20
D. 10
-
Câu 19:
Cân bằng phản ứng H2 + I2 ⇆ 2HI (ΔH < 0) được thiết lập ở toC khi nồng độ các chất ở trạng thái cân bằng là [H2] = 0,8 mol/l; [I2] = 0,6 mol/l ; [HI] = 0,96 mol/l. Hằng số K có giá trị là
A. 1,92.10-2.
B. 1,82.10-2.
C. 1,92.
D. 1,82.
-
Câu 20:
Xét cân bằng: N2O4 (k) ⇆ 2NO2 (k) ở 25oC. Khi chuyển dịch sang một trạng thái cân bằng mới nếu nồng độ của N2O4 tăng lên 9 lần thì nồng độ của NO2
A. tăng 9 lần.
B. tăng 3 lần.
C. tăng 4,5 lần.
D. giảm 3 lần.
-
Câu 21:
Cho cân bằng: 2SO2 (k) + O2 (k) ⇆ 2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là:
A. Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
B. Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
-
Câu 22:
Ở cùng một nồng độ, phản ứng nào dưới đây có tốc độ phản ứng xảy ra chậm nhất.
A. Al + dd NaOH ở 25oC
B. Al + dd NaOH ở 30oC
C. Al + dd NaOH ở 40oC
D. Al + dd NaOH ở 50oC
-
Câu 23:
Có 3 cốc chứa 20ml dung dịch H2O2 cùng nồng độ. Tiến hành 3 thí nghiệm như hình vẽ sau.
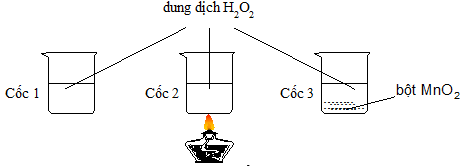
Ở thí nghiệm nào có bọt khí thoát ra chậm nhất?
A. Thí nghiệm 1
B. Thí nghiệm 2
C. Thí nghiệm 3
D. 3 thí nghiệm như nhau
-
Câu 24:
Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn?
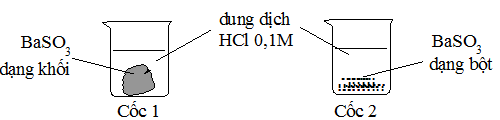
A. Cốc 1 tan nhanh hơn.
B. Cốc 2 tan nhanh hơn.
C. Tốc độ tan ở 2 cốc như nhau.
D. BaSO3 tan nhanh nên không quan sát được.
-
Câu 25:
Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng?
A. Nung kaliclorat ở nhiệt độ cao.
B. Nung hỗn hợp kali clorat và mangan đioxit ở nhiệt độ cao.
C. Dùng phương pháp dời nước để thu khí oxi.
D. Dùng phương pháp dời không khí để thu khí oxi.
-
Câu 26:
Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây ?
A. Dạng viên nhỏ.
B. Dạng bột mịn, khuấy đều.
C. Dạng tấm mỏng.
D. Dạng nhôm dây.
-
Câu 27:
So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, khối lượng Zn sử dụng là như nhau).
Zn (bột) + dung dịch CuSO4 1M (1)
Zn (hạt) + dung dịch CuSO4 1M (2)
Kết quả thu được là
A. (1) nhanh hơn (2).
B. (2) nhanh hơn (1).
C. như nhau.
D. ban đầu như nhau, sau đó (2) nhanh hơn(1).
-
Câu 28:
Thực hiện 2 thí nghiệm theo hình vẽ sau.
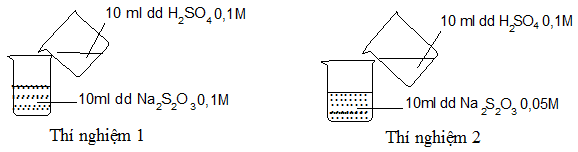
Ở thí nghiệm nào có kết tủa xuất hiện trước?
A. TN1 có kết tủa xuất hiện trước.
B. TN2 có kết tủa xuất hiện trước.
C. Kết tủa xuất hiện đồng thời.
D. Không có kết tủa xuất hiện
-
Câu 29:
Cho cân bằng 2SO2 (k) + O2 (k) ⇌ 2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi. Phát biểu đúng khi nói về cân bằng này là.
A. Phản ứng nghịch toả nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
B. Phản ứng thuận toả nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
C. Phản ứng nghịch thu nhiệt, cân bằng dịch chuyển theo chiều thuận khi tăng nhiệt độ.
D. Phản ứng thuận thu nhiệt, cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ.
-
Câu 30:
Cho các cân bằng sau.
(1) 2HI (k)⇌ H2 (k) + I2 (k)
(2) CaCO3 (r) ⇌ CaO (r) + CO2 (k)
(3) FeO (r) + CO (k) ⇌ Fe (r) + CO2 (k)
(4) 2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
Khi tăng áp suất của hệ, số cân bằng bị chuyển dịch theo chiều nghịch là.
A. 4
B. 3
C. 1
D. 2
-
Câu 31:
Cho phản ứng . N2 + O2 ⇌ 2NO có KC= 36. Biết rằng nồng độ ban đầu của N2 và O2 đều bằng 0,01 mol/l.Hiệu suất của phản ứng tạo NO là .
A. 75%
B. 80%
C. 50%
D. 40%
-
Câu 32:
Cho cân bằng hoá học sau. 2SO2 (k) + O2 (k) ⇌ 2SO3 (k); ΔH < 0. Cho các biện pháp. (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp nào làm cân bằng trên chuyển dịch theo chiều thuận?
A. (2), (3), (4), (6).
B. (1), (2), (4).
C. (1), (2), (4), (5).
D. (2), (3), (5).
-
Câu 33:
Cho cân bằng hoá học
PCl5(k) ⇌ PCl3(k)+Cl2(k) ΔH > 0
Cân bằng chuyển dịch theo chiều thuận khi
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
C. thêm Cl2 vào hệ phản ứng.
D. tăng áp suất của hệ phản ứng.
-
Câu 34:
Hệ cân bằng sau được thực hiện trong bình kín.
CO (k) + H2O (k) ⇌ CO2 (k) + H2 (k) ΔH < 0
Cân bằng trên chuyển dịch theo chiều thuận khi
A. Thêm khí H2 vào hệ.
B. Tăng áp suất chung của hệ.
C. Cho chất xúc tác vào hệ.
D. Giảm nhiệt độ của hệ.
-
Câu 35:
Cho phương trình hoá học của phản ứng tổng hợp amoniac
N2 (k) + 3H2 (k) ⇔ 2NH3 (k)
Khi tăng nồng độ của hidro lên 3 lần, tốc độ phản ứng thuận
A. tăng lên 9 lần.
B. giảm đi 3 lần.
C. tăng lên 27 lần.
D. giảm đi 27 lần
-
Câu 36:
Cho Fe (hạt) phản ứng với dung dịch HCl 1M. Thay đổi các yếu tố sau.
(1) Thêm vào hệ một lượng nhỏ dung dịch CuSO4.
(2) Thêm dung dịch HCl 1M lên thể tích gấp đôi.
(3) Nghiền nhỏ hạt sắt thành bột sắt.
(4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi.
Có bao nhiêu cách thay đổi tốc độ phản ứng?
A. 1
B. 4
C. 3
D. 2
-
Câu 37:
Cho các phát biểu sau
(1) Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
(2) Chất xúc tác có tác dụng làm tăng tốc độ phản ứng thuận và nghịch.
(3) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
(4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
(5) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
(6) Sự chuyển dịch cân bằng của phản ứng thuận nghịch 2NO2 ⇌ N2O4 không phụ thuộc sự thay đổi áp suất.
Số phát biểu sai là
A. 1
B. 2
C. 3
D. 4
-
Câu 38:
Cho phương trình hoá học
N2 (k) + O2 (k) ⇌ 2NO (k) ΔH > 0
Hãy cho biết cặp yếu tố nào sau đây đều ảnh hưởng đến sự chuyển dịch cân bằng hoá học trên?
A. Nhiệt độ và nồng độ.
B. Áp suất và nồng độ.
C. Nồng độ và chất xúc tác.
D. Chất xúc tác và nhiệt độ.
-
Câu 39:
Cho phản ứng thuận nghịch ở trạng thái cân bằng
4NH3 (k) + 3O2 (k) ⇌ 2N2 (k) + 6H2O (h) ΔH < 0
Cân bằng sẽ chuyển dịch theo chiều thuận khi .
A. Tăng nhiệt độ.
B. Thêm chất xúc tác.
C. Tăng áp suất.
D. Loại bỏ hơi nước.
-
Câu 40:
Cho cân bằng hóa học. 2SO2 (k) + O2 (k) ⇌ 2SO3 (k); phản ứng thuận là phản ứng tỏa nhiệt. Phát biểu đúng là.
A. Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
B. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
C. Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
D. Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
-
Câu 41:
Phản ứng 2SO2 + O2 ⇌ 2SO3 ΔH < 0. Khi giảm nhiệt độ và khi giảm áp suất thì cân bằng của phản ứng trên chuyển dịch tương ứng là
A. Thuận và thuận.
B. Thuận và nghịch.
C. Nghịch và nghịch.
D. Nghịch và thuận.
-
Câu 42:
Cho các phản ứng.
(1) H2 (k) + I2 (k) ⇌ 2HI (k)
(2) 2SO2 (k) + O2 (k) ⇌ 2SO3 (k)
(3) 3H2 (k) + N2 (k) ⇌ 2NH3 (k)
(4) N2O4 (k)⇌ 2NO2 (k)
Các phản ứng chuyển dịch theo chiều nghịch khi ta giảm áp suất của hệ là
A. (2), (3).
B. (2), (4).
C. (3), (4).
D. (1), (2).
-
Câu 43:
Cho các cân bằng.
(1) H2 (k) + I2 (k) ⇌ 2HI (k)
(2) 2NO (k) + O2 (k) ⇌ 2NO2 (k)
(3) CO(k) + Cl2(k) ⇌ COCl2 (k)
(4) CaCO3 (r) ⇌ CaO (r) + CO2 (k)
(5) 3Fe (r) + 4H2O (k) ⇌ Fe3O4 (r) + 4H2 (k)
Các cân bằng chuyển dịch theo chiều thuận khi tăng áp suất là
A. (1), (4).
B. (1), (5).
C. (2), (3), (5).
D. (2), (3).
-
Câu 44:
Cho ba mẫu đá vôi (100% CaCO3) có cùng khối lượng. mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. t3 < t2 < t1
B. t1 < t2 < t1
C. t1 = t2 = t3
D. t2 < t1 < t3
-
Câu 45:
Thực hiện phản ứng sau trong bình kín. H2(k) + Br2(k) → 2HBr (k)
Lúc đầu nồng độ hơi Br2 là 0,072 mol/l. Sau 2 phút, nồng độ hơi Br2 còn lại là 0,048 mol/l. Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là.
A. 8.10-4 mol/(l.s)
B. 6.10-4 mol/(l.s)
C. 4.10-4 mol/(l.s)
D. 2.10-4 mol/(l.s)
-
Câu 46:
Xét cân bằng. N2O4 (k) ⇌ 2NO2 (k) ở 25oC. Khi chuyển dịch sang một trạng thái cân bằng mới nếu tăng nồng độ của N2O4 lên 9 lần thì nồng độ của NO2
A. tăng 9 lần.
B. tăng 3 lần.
C. tăng 4,5 lần.
D. giảm 3 lần
-
Câu 47:
Cho phương trình hoá học của phản ứng tổng hợp amoniac.
N2(k) + 3H2(k) ⇔ 2NH3(k)
Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận.
A. giảm đi 2 lần.
B. tăng lên 2 lần.
C. tăng lên 8 lần.
D. tăng lên 6 lần.
-
Câu 48:
Trong một phản ứng thuận nghịch, ở trạng thái cân bằng thì:
A. Các phản ứng thuận và nghịch đều dừng lại
B. Nồng độ các chất trong hệ có giá trị cao nhất
C. Tốc độ của phản ứng thuận và nghịch gần bằng nhau
D. Nồng độ các chất trong hệ không thay đổi, được gọi là nồng độ cân bằng.
-
Câu 49:
Nồng độ ban đầu của A2 và B2 là 0,03 mol/l. Khi phản ứng: A2(k) + B2(k) ⇋ 2AB(k);
Khi đạt trạng thái cân bằng, nồng độ của AB là 0,04 mol/l. Hằng số cân bằng của phản ứng trên là:
A. 9
B. 16
C. 32
D. 64
-
Câu 50:
Cho cân bằng hóa học: H2 (k) +I2 (k) ⇋ 2HI (k); ΔH > 0
Cân bằng không bị chuyển dịch khi
A. Tăng nhiệt độ của hệ
B. Giảm nống độ HI
C. Tăng nồng độ H2
D. Giảm áp suất chung của hệ.














