Đề thi giữa HK1 môn Hóa học 11 năm 2022-2023
Trường THPT Nguyễn Huệ
-
Câu 1:
Cho phản ứng sau: FeS + 2HCl → FeCl2 + H2S. Phương trình ion rút gọn là
A. 2H+ + S2- → H2S.
B. Fe2+ + S2- + 2H+ → Fe2+ + H2S.
C. FeS + 2H+ → Fe2+ + H2S.
D. Fe + S2- + 2H+ → Fe2+ + H2S.
-
Câu 2:
Cho các dung dịch sau: Na2CO3, AlCl3, Ba(NO3)2, NaCl. Dung dịch có pH < 7 là
A. Na2CO3.
B. AlCl3.
C. Ba(NO3)2.
D. NaCl.
-
Câu 3:
Nhận định đúng về tính chất hóa học của N2 là
A. N2 tác dụng với nhiều phi kim ở điều kiện thường.
B. N2 tác dụng với tất cả các kim loại tạo muối nitrua.
C. N2 có tính chất hóa học chủ yếu là tính oxi hóa.
D. N2 tác dụng với oxi ở điều kiện thường.
-
Câu 4:
Nhận định đúng về tính chất NH3 là
A. Trong phân tử NH3, N chỉ còn 1 electron hóa trị.
B. Amoniac là chất khí mùi khai, không màu, nhẹ hơn không khí.
C. Amoniac tan nhiều trong nước tạo dung dịch bazo mạnh.
D. Amoniac tác dụng với tất cả các dung dịch muối.
-
Câu 5:
Cho dãy chuyển hóa: P \(\xrightarrow{+X}\) H3PO4 \(\xrightarrow{+Y}\) NaH2PO4 \(\xrightarrow{+Y}\) Na3PO4. Các chất X, Y lần lượt có thể là
A. H2SO4, BaCl2.
B. H2SO4, NaCl.
C. HNO3, Na2SO4.
D. HNO3, NaOH.
-
Câu 6:
Cho các chất sau tan trong nước: Na2CO3, CH3COOCH3, HCOOH, MgCl2, HF. Số chất điện li mạnh và điện li yếu lần lượt là
A. 2; 2.
B. 3; 2.
C. 1; 4.
D. 3: 1.
-
Câu 7:
Cho các sơ đồ phản ứng sau
1. NaOH + HCl →
2. KHCO3 + KOH →
3. Cu(OH)2 + H2SO4 →
4. Ba(OH)2 + HNO3 →
Số phản ứng có cùng phương trình ion rút gọn là
A. 1
B. 2
C. 3
D. 4
-
Câu 8:
Cho phản ứng: Al + HNO3 → Al(NO3)3 + NO2 + H2O. Tổng hệ số (nguyên, có tỉ lệ tối giản) của các chất là
A. 13
B. 14
C. 15
D. 16
-
Câu 9:
Nhiệt phân hỗn hợp gồm các muối KNO3, NH4NO3, AgNO3, Cu(NO3)2 thu được chất rắn X có thành phần là
A. K2O, Ag, Cu.
B. KNO2, Ag2O, CuO.
C. KNO2, Ag, CuO.
D. K2O, Ag2O, Cu.
-
Câu 10:
Chất không điện li là
A. CH3OH.
B. CH3COOH.
C. NaF.
D. HF.
-
Câu 11:
Nhận định đúng về N2 là
A. Khí N2 hơi nặng hơn không khí.
B. Khí N2 không duy trì sự cháy.
C. Khí N2 tan tốt trong nước.
D. Khí N2 chiếm rất ít trong không khí.
-
Câu 12:
Phương trình ion thu gọn H+ + OH- → H2O biểu diễn bản chất của phản ứng hóa học nào sau đây ?
A. H2SO4 + BaCl2 → BaSO4 + 2HCl.
B. 3HCl + Fe(OH)3 → 3FeCl3 + 3H2O.
C. H2SO4 + 2NaOH → Na2SO4 + 2H2O.
D. NaOH + NaHCO3 → Na2CO3 + H2O.
-
Câu 13:
Thực hiện thí nghiệm như hình vẽ dưới đây
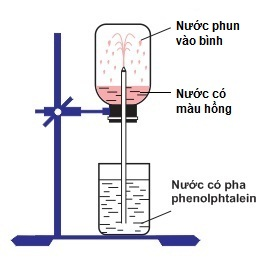
Bên trong bình, lúc đầu có chứa khí X. Hiện tượng xảy ra khi tiến hành thí nghiệm: nước phun mạnh vào bình và chuyển thành màu hồng. Khí X là
A. NH3.
B. HCl.
C. CO2.
D. N2.
-
Câu 14:
Cho dãy chuyển hóa: HNO3 \(\xrightarrow{+X}\) NH4NO3 \(\xrightarrow{+Y}\) NH3 \(\xrightarrow{+Z}\) N2. Các chất X, Y, Z lần lượt có thể là
A. Mg, BaCl2, Na2O.
B. Cu, BaCl2, CuO.
C. Mg, NaOH, O2.
D. Cu, NaOH, MgO.
-
Câu 15:
Cho các dung dịch sau: NaHSO4, AlCl3, K2SO4, K2S, Ba(NO3)2. Số dung dịch có pH < 7 là
A. 1
B. 2
C. 3
D. 4
-
Câu 16:
Cho các chất sau: FeO, Na2SO4, NH3, Cu(OH)2, MgO. Số chất tác dụng với dung dịch HNO3 là
A. 2
B. 3
C. 4
D. 5
-
Câu 17:
Cho phản ứng sau: aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Hệ số a, b, c, d, e là các số nguyên, tối giản. Tổng (a+b) bằng
A. 4
B. 6
C. 7
D. 5
-
Câu 18:
Cho các sơ đồ phản ứng sau:
1. NaOH + CuCl2 →
2. (NH4)2S + Ba(OH)2 →
3. NH4Cl + NaOH →
4. MgCO3 + HCl →
5. NH4NO3 + KOH →
6. NH4Cl + AgNO3 →
Phản ứng có cùng phương trình ion rút gọn
A. 1, 3, 5.
B. 2, 5, 6.
C. 2, 3, 5.
D. 1, 5, 6.
-
Câu 19:
Cho 500 ml dung dịch NaOH 0,2M; NaAlO2 0,1M vào 500 ml dung dịch Ba(OH)2 0,1M; Ba(AlO2)2 0,1M thu được dung dịch A. Nồng độ ion OH- và AlO2- trong dung dịch A lần lượt là
A. 0,2M; 0,15M.
B. 0,3M; 0,2M.
C. 0,2M; 0,3M.
D. 0,3M và 0,15M.
-
Câu 20:
Hòa tan hết m gam Al trong 100 ml dung dịch NaOH 0,3M, sau phản ứng thu được dung dịch A và 0,672 lít khí H2. Dung dịch A có pH là
A. 11
B. 12
C. 13
D. 14
-
Câu 21:
Cho 6,72 lít khí N2 tác dụng với 13,44 lít khí H2 với điều kiện thích hợp thu được V lít hỗn hợp khí (biết H% = 20%). Biết các khí được đo ở điều kiện tiêu chuẩn. Giá trị V là
A. 13,440.
B. 14,560.
C. 16,576.
D. 18,368.
-
Câu 22:
Cho 200 ml dung dịch chứa NaCl 0,1 M; Na2SO4 0,2M vào 300 ml dung dịch chứa H2SO4 0,1M; KCl 0,1M thu được 500 ml dung dịch A. Nồng độ ion SO42-, Na+ trong dung dịch A lần lượt là
A. 0,10M và 0,07M.
B. 0,14M và 0,20M.
C. 0,14M và 0,07M.
D. 0,10M và 0,20M.
-
Câu 23:
Cho 100 ml dung dịch A chứa HCl 0,05M, H2SO4 0,025M vào 400 ml dung dịch B chứa NaOH 0,035M, Ba(OH)2 0,02M thu được dung dich có pH = x. Giá trị x là
A. 1,4.
B. 11,8.
C. 2,2.
D. 12,6.
-
Câu 24:
Cho 17,92 lít hỗn hợp N2, H2 nung trong điều kiện thích hợp sau một thời gian thu được 13,888 lít hỗn hợp khí với hiệu suất 30% tính theo N2. Biết các khí đều được đo ở điều kiện tiêu chuẩn. Thể tích N2 trong hỗn hợp ban đầu là
A. 6,72.
B. 8,96.
C. 5,60.
D. 10,08.
-
Câu 25:
Trộn 50 ml dung dịch NaOH 0,05M với 50 ml dung dịch Ba(OH)2 0,025M thu được dung dịch có pH bằng
A. 10,7
B. 11,5.
C. 12,7.
D. 13,0.
-
Câu 26:
Đổ dung dịch X chứa 0,01 mol Fe3+, x mol Cl- và 0,01 mol SO42- vào dung dịch Y chứa y mol Ba2+, 0,03 mol OH-, 0,01 mol AlO2- thu được m gam kết tủa. Giá trị m là
A. 3,2.
B. 3,4.
C. 4,6.
D. 4,9.
-
Câu 27:
Hòa tan 24 gam hỗn hợp kim loại Fe, Cu trong dung dịch HNO3 thu được dung dịch muối và 2,24 lít N2O. Phần trăm khối lượng Cu trong hỗn hợp là
A. 7,68.
B. 9,60.
C. 12,8
D. 15,36.
-
Câu 28:
Hòa tan 29,4 gam H3PO4 trong 350 ml dung dịch NaOH 2M thu được dung dịch X. Khối lượng của muối có phân tử khối lớn hơn trong dung dịch X là
A. 16,40.
B. 32,80.
C. 41,00.
D. 49,20.
-
Câu 29:
Hòa tan 16,8 gam kim loại M trong dung dịch HNO3 thu được dung dịch muối và 20,16 lít khí NO2 (đktc). Kim loại M là
A. Al.
B. Fe.
C. Cu.
D. Ag.
-
Câu 30:
Hòa tan 50 ml dung dịch chứa HCl 0,01M, HNO3 0,01M vào 50 ml dung dịch H2SO4 0,005M thu được dung dịch B. Dung dịch B có pH bằng:
A. 1,60.
B. 1,82.
C. 1,70.
D. 2,00.
-
Câu 31:
Cho cốc (1) chứa 0,01 mol Mg2+, x mol NH4+, 0,03 mol NO3- vào cốc (2) chứa 0,025 mol Na+, y mol OH-, 0,01 mol CO32- nhận thấy khối lượng dung dịch thu được giảm bao nhiêu gam?
A. 1,010.
B. 0,590.
C. 0,925.
D. 1,850.
-
Câu 32:
Hòa tan 12,9 gam hỗn hợp kim loại Mg, Al trong dung dịch HNO3 dư thu được dung dịch A chứa a gam muối và 8,96 lít (đktc) hỗn hợp khí N2, NO2 có tỉ lệ lần lượt là 1 : 3 (ngoài ra không còn sản phẩm khử khác). Khối lượng Mg trong hỗn hợp đầu là
A. 2,4.
B. 4,8.
C. 7,2
D. 9,6.
-
Câu 33:
Cho 19,6 gam axit photphoric tác dụng với 300 ml dung dịch NaOH 1M thu được dung dịch X. Khối lượng chất tan có trong dung dịch X là
A. 65,5.
B. 52,4.
C. 39,3.
D. 26,2.
-
Câu 34:
Hòa tan kim loại hóa trị không đổi bằng dung dịch HNO3 thu được dung dịch chứa 113,4 gam muối và 2,688 lít (đktc) khí không màu và tương đối trơ ở điều kiện thường (sản phẩm khử duy nhất). Kim loại là
A. Mg.
B. Zn.
C. Al.
D. Fe.
-
Câu 35:
Nhiệt phân hoàn toàn m gam muối nitrat thu được 16,2 gam kim loại và 5,04 lít hỗn hợp (đktc). Công thức hóa học của muối là
A. Hg(NO3)2.
B. Zn(NO3)2.
C. Cu(NO3)2.
D. AgNO3.
-
Câu 36:
Hòa tan 6 gam Mg trong dung dịch HNO3 dư thu được dung dịch muối và 3,36 lít (đktc) hỗn hợp khí NO2, khí X có tỉ lệ về thể tích là 2 : 1. Công thức khí X là
A. N2.
B. N2O.
C. NO.
D. N2O5.
-
Câu 37:
Nhiệt phân hoàn toàn 37,8 gam muối nitrat có hóa trị không đổi thu được oxit kim loại và 11,2 lít hỗn hợp khí (đktc) có khối lượng 21,6 gam. Công thức của muối nitrat là
A. Al(NO3)3.
B. Cu(NO3)2.
C. Zn(NO3)2.
D. AgNO3.
-
Câu 38:
Hòa tan hoàn toàn 13 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí N2(đktc). Khối lượng muối trong dung dịch X là
A. 37,8 gam
B. 18,9 gam
C. 28,35 gam
D. 39,8 gam
-
Câu 39:
Dung dịch X gồm a mol Na+; 0,15 mol K+; 0,1 mol HCO3-; 0,15 mol CO32- và 0,05 mol SO42-. Tổng khối lượng muối trong dung dịch X là
A. 33,8 gam
B. 28,5 gam
C. 29,5 gam
D. 31,3 gam
-
Câu 40:
Cho 3,2 gam Cu tác dụng với 100 ml dung dịch gồm HNO30,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 0,448
B. 0,792
C. 0,672
D. 0,746














