10 Đề thi kiểm tra cuối HK1 môn Hóa học lớp 10 - Cánh Diều - Đề 1
28 câu hỏi 60 phút
Công thức cấu tạo của phân tử cafein, một chất gây đắng tìm thấy nhiều trong cafe và trà được biểu diễn ở hình dưới
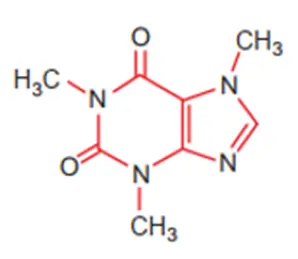
Nguyên tố N tạo nên cafein, có vị trí trong bảng tuần hoàn là
ô số 6, chu kì 3, nhóm IIA
ô số 4, chu kì 2, nhóm VIA
ô số 5, chu kì 4, nhóm IVA
ô số 7, chu kì 2, nhóm VA
Nitơ có ký hiệu hóa học là N, số hiệu nguyên tử \(Z=7\).
Ô số = số hiệu nguyên tử = 7 \(\Rightarrow \) ô số 7.
Cấu hình electron:\(\text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{3}}}\) \(\Rightarrow \) Lớp ngoài cùng là lớp 2 \(\Rightarrow \) Chu kì 2.
Nhóm: Số electron lớp ngoài cùng = 5 (nhóm VA).
Danh sách câu hỏi:
Nitơ có ký hiệu hóa học là N, số hiệu nguyên tử \(Z=7\).
Ô số = số hiệu nguyên tử = 7 \(\Rightarrow \) ô số 7.
Cấu hình electron:\(\text{1}{{\text{s}}^{\text{2}}}\text{2}{{\text{s}}^{\text{2}}}\text{2}{{\text{p}}^{\text{3}}}\) \(\Rightarrow \) Lớp ngoài cùng là lớp 2 \(\Rightarrow \) Chu kì 2.
Nhóm: Số electron lớp ngoài cùng = 5 (nhóm VA).
Số hiệu nguyên tử của helium là 2.
Cấu hình electron: \(1{{s}^{2}}\) → Lớp electron ngoài cùng là lớp 1 (chỉ có 1 lớp) \(\Rightarrow \) Chu kỳ 1.
Lớp ngoài cùng đã bão hòa (2/2 electron)\(\Rightarrow \)thuộc nhóm VIIIA (nhóm khí hiếm).
Tất cả các nguyên tố được liệt kê trong hình đều thuộc nhóm IA và có 1 electron ở lớp ngoài cùng.
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.
N2 – Liên kết giữa 2 nguyên tử N (cùng nguyên tố) \(\Rightarrow \) liên kết cộng hóa trị không phân cực.
H2 – Liên kết giữa 2 nguyên tử H (cùng nguyên tố) \(\Rightarrow \) không phân cực.
Câu 7:
Dựa vào giá trị độ âm điện của S là 2,58 và O là 3,44. Loại liên kết trong các phân tử SO3 là
Câu 18:
Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hoá trị không phân cực?
Câu 19:
Trong bảng tuần hoàn các nguyên tố hóa học
Osimi (Os) là kim loại nặng nhất
Potassium (K) không tác dụng với nước
Fluorine (F) là phi kim hoạt động mạnh nhất
Caesium (Cs) là kim loại hoạt động yếu nhất
Câu 20:
Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn
Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một cột
Các nguyên tố có cùng số electron hóa trị được xếp vào một hàng
Số thứ tự của ô nguyên tố bằng số hiệu của nguyên tố đó
Câu 21:
Trong một nguyên tử trung hòa về điện, ở trạng thái cơ bản
Hạt mang điện tích âm là proton
Hạt không mang điện là electron
Hạt mang điện tích âm là notron
Tổng số hạt proton bằng tổng số hạt electron
Câu 22:
Các loại liên kết hydrogen, liên kết cộng hóa trị, liên kết ion và tương tác van der Waals
\(\mathrm{HF}, \mathrm{H}_2 \mathrm{O}, \mathrm{NH}_3\) có liên kết hydrogen
\(\mathrm{CH}_4\) là liên kết ion
Tương tác giữa các phân tử He là tương tác Van der Waals
Liên kết trong phân tử NaCl là liên kết cộng hoá trị