10 Đề thi kiểm tra cuối HK1 môn Hóa học lớp 10 - Cánh Diều - Đề 3
28 câu hỏi 60 phút
Lớp vỏ nguyên tử được tạo thành từ các hạt
neutron và proton
electron
proton
neutron và electron
Lớp vỏ nguyên tử được tạo thành từ các hạt electron.
Danh sách câu hỏi:
Lớp vỏ nguyên tử được tạo thành từ các hạt electron.
Sự xen phủ bên \(\mathrm{p}-\mathrm{p}\) hình thành liên kết \(\mathrm{pi}(\pi)\), không hình thành liên kết sigma \((\sigma)\).
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân.
Lớp electron thứ 2 chỉ có 2 phân lớp là 2s và 2p, không có phân lớp 2d.
- Hai nguyên tử O trong phân tử \(\mathrm{O}_2\) có độ âm điện bằng nhau nên cặp electron dùng chung không bị lệch.
\(\Rightarrow\) Liên kết cộng hóa trị không phân cực.
- Trong phân tử \(\mathrm{HCl}, \mathrm{NH}_3, \mathrm{SO}_2\) có hiệu độ âm điện giữa các nguyên tử khác 0 nên cặp electron bị lệch về phía nguyên tử có độ âm điện lớn hơn \((\mathrm{Cl}, \mathrm{N}, \mathrm{O})\). \(\rightarrow\) Liên kết cộng hóa trị phân cực.
Câu 19:
Cho phổ khối lượng của nguyên tố magnesium như hình sau:
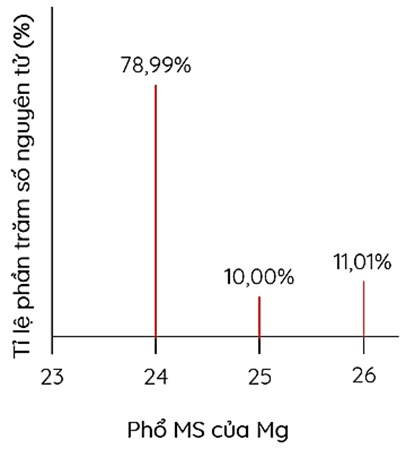
Magnesium có 3 đồng vị bền trong tự nhiên
Trong tự nhiên tồn tại nguyên tử magnesium có 15 neutron
Nguyên tử khối trung bình của magnesium là 24,32
Trong \(\mathrm{MgCO}_3,{ }^{24} \mathrm{Mg}\) chiếm \(28,46 \%\) về khối lượng
Câu 20:
Oxygen \(\left({ }_8 \mathrm{O}\right)\) và fluorine \(\left({ }_9 \mathrm{~F}\right)\) đều thuộc chu kì 2 trong bảng tuần hoàn các nguyên tố hóa học
Nguyên tử oxygen và fluorine đều có 2 lớp electron
Oxygen có tính phi kim mạnh hơn fluorine
Khả năng hút electron của fluorine mạnh hơn oxygen
Trong hợp chất khí với hydrogen, fluorine chiếm 95% về khối lượng
Câu 21:
Ethanol là hợp chất hữu cơ dễ cháy, không màu, thành phần chính trong các đồ uống có cồn. Ethanol có công thức cấu tạo như sau:

Số hiệu nguyên tử của H, C, O lần lượt là 1, 6 và 8
Trong phân tử ethanol chỉ có liên kết đơn
Khi hình thành phân tử ethanol, các nguyên tử C, H, O đều có 8 electron lớp ngoài cùng
Các liên kết trong phân tử ethanol đều được tạo thành từ sự xen phủ trục s – p
Ethanol tan tốt trong nước do tạo được liên kết hydrogen với nước
Câu 22:
Nguyên tố nitrogen (N, Z = 7) và phosphorus (P, Z = 15) là các nguyên tố điển hình của nhóm VA trong bảng tuần hoàn
Các nguyên tử N và P đều có 3 electron ở lớp ngoài cùng
Khi tham gia liên kết hóa học, N và P có xu hướng nhận hoặc góp chung 3 electron
Hợp chất khí với H với P là \(\mathrm{PH}_3\), công thức oxide ứng với hóa trị cao nhất là \(\mathrm{P}_2 \mathrm{O}_5\)
\(\mathrm{NH}_3\) có nhiệt độ sôi cao hơn \(\mathrm{PH}_3\) do giữa các phân tử \(\mathrm{NH}_3\) có liên kết hydrogen
