60 câu trắc nghiệm cuối HK1 Hóa học 10 - Cánh Diều - Đề 1
28 câu hỏi 60 phút
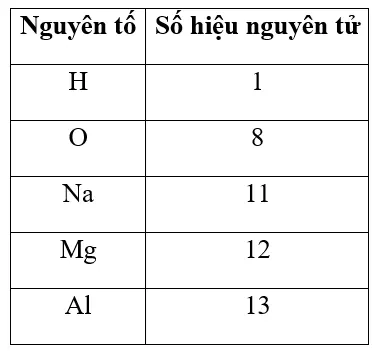
Nguyên tử silicon có 14 electron ở lớp vỏ. Điện tích hạt nhân nguyên tử này là
-28
+28
+14
-14
Nguyên tử trung hòa về điện nên số proton bằng số electron.
⇒ Số proton trong hạt nhân nguyên tử silicon là 14.
⇒ Điện tích hạt nhân nguyên tử silicon là +14.
Danh sách câu hỏi:
Nguyên tử trung hòa về điện nên số proton bằng số electron.
⇒ Số proton trong hạt nhân nguyên tử silicon là 14.
⇒ Điện tích hạt nhân nguyên tử silicon là +14.
Liên kết ba được hình thành từ 1 liên kết sigma \((\sigma)\) và 2 liên kết pi \((\pi)\).
Ta có: Z = p = 13; A = Z + n = 13 + 14 = 27.
⇒ Kí hiệu nguyên tử: \(_{13}^{27}Al\).
Orbital nguyên tử là khu vực xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
Năng lượng liên kết là đại lượng đặc trưng cho độ bền của liên kết.
Câu 19:
Cho phổ khối lượng của chlorine (Cl) và silver (Ag) như hình sau:
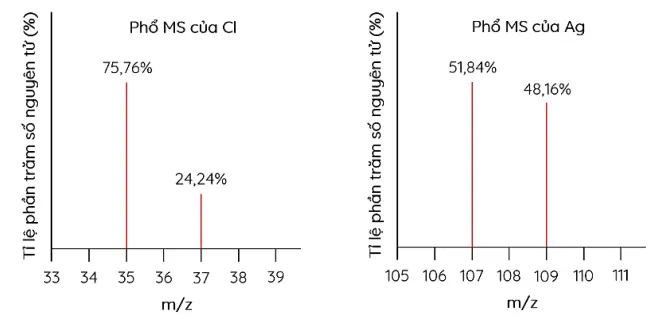
Trong tự nhiên, silver có hai đồng vị bền là \({ }^{107} \mathrm{Ag}\) và \({ }^{109} \mathrm{Ag}\)
Tồn tại nguyên tử chlorine có 19 neutron trong hạt nhân
Trong tự nhiên có hai loại phân tử AgCl khác nhau
Phần trăm khối lượng của \({ }^{107} \mathrm{Ag}\) trong AgCl là \(75,26 \%\)
Câu 20:
Potassium (19K) và calcium (20Ca) đều thuộc chu kì 4 trong bảng tuần hoàn
Potassium và calcium đều là nguyên tố phi kim
Potassium có bán kính nguyên tử lớn hơn calcium
Hóa trị cao nhất của calcium là II
Trong potassium hydroxide, potassium chiếm 69,64% về khối lượng
Câu 21:
Hydrogen sulfide \(\left(\mathrm{H}_2 \mathrm{~S}\right)\) không màu, mùi trứng thối. Nồng độ \(\mathrm{H}_2 \mathrm{~S}\) gây kích thích màng phổi, có thể dẫn đến tử vong. Số đơn vị điện tích hạt nhân của H và S lần lượt là 1 và 16
Nguyên tử \(S\) cần thêm 2 electron để đạt được cấu hình electron của Ar
Liên kết trong phân tử \(\mathrm{H}_2 \mathrm{~S}\) là liên kết cộng hóa trị
Liên kết trong phân tử \(\mathrm{H}_2 \mathrm{~S}\) được hình thành do sự xen phủ trục \(\mathrm{s}-\mathrm{p}\)
Trong một phân tử \(\mathrm{H}_2 \mathrm{~S}\) có một liên kết \(\sigma\) và một liên kết \(\pi\)
Câu 22:
Cho các nguyên tố hóa học sau: oxygen (O, Z = 8), sulfur (S, \(Z=16\)), selenium (Se, Z = 34), telurium (Te, Z = 52). Các nguyên tố này đều thuộc nhóm VIA trong bảng tuần hoàn
Các nguyên tử O, S, Se, Te đều có 6 electron ở lớp ngoài cùng
Các nguyên tử O, S đều có xu hướng nhường 2 electron khi tham gia liên kết hóa học
Hydroxide ứng với hóa trị cao nhất của S là H2SO4 - một acid mạnh
Trong dãy hợp chất khí với H, H2O có nhiệt độ sôi cao nhất do tương tác van der Waals mạnh nhất