60 câu trắc nghiệm cuối HK1 Hóa học 10 - Cánh Diều - Đề 2
28 câu hỏi 60 phút
Hạt mang điện trong hạt nhân nguyên tử là
proton và electron
proton
neutron
proton và neutron
Hạt mang điện trong hạt nhân chỉ có proton.
Danh sách câu hỏi:
Hạt mang điện trong hạt nhân chỉ có proton.
\(_{14}^{28}\text{X},_{14}^{29}\text{Y}:\)có cùng số proton: \(\text{Z}=14\)nhưng khác số khối: \(\text{A}=28\) và \(\text{A}=29\).\(\Rightarrow \) Đây là hai đồng vị của cùng một nguyên tố (Silicon).
Chu kỳ chính là các nguyên tố có cùng số lớp electron.
Câu 4:
Trong một nhóm khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân bán kính nguyên tử
Khi đi từ trên xuống dưới trong một nhóm, số lớp electron tăng lên, làm bán kính nguyên tử tăng mặc dù điện tích hạt nhân tăng.
Ô nguyên tố nitrogen có ghi số 7 ở trên cùng, đó là số hiệu nguyên tử (Z = 7), tức số proton trong hạt nhân.
Câu 19:
Cho nguyên tử sunfua (lưu huỳnh) có Z = 16, N = 16
Số khối của nguyên tử sunfua là 16
Sunfua là một nguyên tố phi kim do có 6 electron thuộc lớp ngoài cùng
Ở trạng thái cơ bản, nguyên tử sunfua có số orbital chứa eletron là 8
Trong bảng tuần hoàn các nguyên tố sunfua nằm ở chu kì 3
Câu 20:
Aluminium có rất nhiều ứng dụng trong cuộc sống. Aluminium được dùng để sản xuất các thiết bị và dụng cụ sinh hoạt như nồi, chảo, các đường dây tải điện, các loại cửa,… đặc biệt dùng trong công nghệ sản xuất vỏ máy bay do nhẹ, bền. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tử Aluminium thuộc chu kì 3 và nhóm IIIA
Trong hạt nhân nguyên tử Aluminium có 13 hạt proton
Nguyên tử Aluminium có 3 lớp electron
Nguyên tố Aluminium có có tính kim loại mạnh hơn nguyên tố có số hiệu 11
Oxide cao nhất của Aluminium có công thức Al2O3 là basic oxide
Câu 21:
Cho 2 nguyên tố X và Y có số hiệu nguyên tử lần lượt là 11 và 8
Số electron hoá trị của X và Y lần lượt là 1 và 2
Hợp chất tạo thành giữa X và Y có liên kết ion và có công thức là X2Y
Hợp chất tạo thành giữa X và Y là chất khí tan tốt trong nước
Khi tạo thành hợp chất, nguyên tử X nhường 2 electron và nguyên tử Y nhận 2 electron
Câu 22:
Ammonia là chất khí không màu có mùi khai là xốc. Amonia là chất trung gian trong sản xuất phân bón. Công thức Lewis của Ammonia hình bên dưới
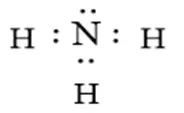
Phân tử Ammonia chứa 3 liên kết cộng hoá trị phân cực, cặp elctron dùng chung lệch về phía nguyên tử hidrogen
Trong phân tử amonia nguyên tử nitrogen còn 1 cặp electron chưa liên kết nên có khả năng hình thành liên kết cho nhận
Khí Ammonia tan tốt trong nước do hình thành liên kết hydrogen với các phân tử nước
Liên kết giữa nguyên tử N và H được hình thành do sự xen phủ của orbital s và p gọi là liên kết \(\pi \)
