10 Đề thi kiểm tra cuối HK1 môn Hóa học lớp 10 - KNTT - Đề 1
28 câu hỏi 60 phút
Các nguyên tử của cùng một nguyên tố hoá học là đồng vị của nhau có sự khác nhau về
số khối
số proton
số electron
điện tích hạt nhân
Các nguyên tử của cùng một nguyên tố hoá học là đồng vị của nhau có sự khác nhau về số khối.
Danh sách câu hỏi:
Các nguyên tử của cùng một nguyên tố hoá học là đồng vị của nhau có sự khác nhau về số khối.
Phân lớp 2d không tồn tại vì với n = 2, giá trị của số lượng tử phụ ℓ chỉ có thể là 0 (s) và 1 (p), không thể là 2 (d).
- 18 cột (gồm 8 nhóm A và 10 nhóm B).
- Nhóm A: các nguyên tố nhóm s và p (cột 1, 2 và 13→18) \(\Rightarrow\) 8 nhóm A.
- Số nhóm B (nhóm phụ): Gồm 8 nhóm (IB đến VIIIB .NhómVIIIB thực chất bao gồm 3 cột (cột 8, 9, 10), nhưng về mặt hóa học được coi là một nhóm.
Cấu hình electron của \(X: 1 s^2 2 s^2 2 p^6 3 s^2 3 p^3 \Rightarrow\) Lớp ngoài cùng: \(3 s^2 3 p^3 \Rightarrow 5\) electron hóa trị \(\Rightarrow\) nhóm VA.
Khối lượng neutron ( \(\approx 1,0087 \mathrm{amu}\) ) lớn hơn một chút so với khối lượng proton ( \(\approx 1,0073 \mathrm{amu}\) ).
Câu 8:
Hạt nhân nguyên tử nguyên tố X có 24 hạt, trong đó số hạt mang điện là 12. Số electron trong X là
Câu 10:
Trong bảng tuần hoàn các nguyên tố, con số trên đầu mỗi ký hiệu hóa học biểu thị thông tin về

Câu 15:
Nguyên tử của nguyên tố \(X\) có cấu hình electron: \(1 s^2 2 s^2 2 p^6 3 s^2 3 p^5 . X\) thuộc nhóm
Câu 19:
Sodium ( \({ }_{11} \mathrm{Na}\) ) và Magnesium ( \({ }_{12} \mathrm{Mg}\) ) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học
Na và Mg đều có 3 electron hóa trị
Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt động hóa học giữa Na với Mg
Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide
Khi phản ứng với Cl2, Na và Mg đều tạo ra hợp chất ion
Câu 20:
Cho độ âm điện của N bằng 3,04; của H bằng 2,2; của C bằng 2,55; của O bằng 3,44
Phân tử \(\mathrm{NO}_2\) và \(\mathrm{NH}_3\) tuân theo quy tắc octet; \(\mathrm{CH}_4\) và \(\mathrm{H}_2 \mathrm{O}\) vi phạm quy tắc octet
Dung dịch \(\mathrm{NH}_3\) có thể tạo được tối đa 4 loại liên kết hydrogen
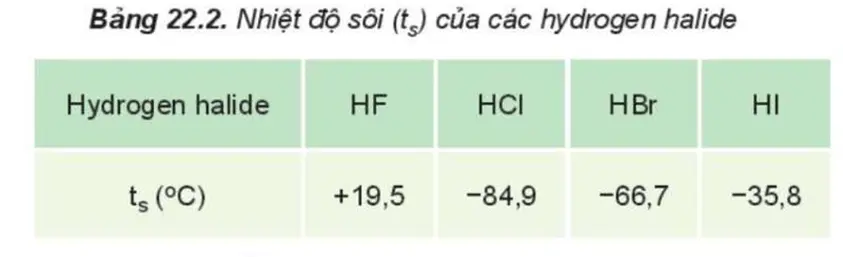
Nhiệt độ sôi của \(\mathrm{H}_2 \mathrm{O}\) cao hơn nhiều so với \(\mathrm{CH}_4\) nhờ có liên kết hydrogen
Nguyên tử C trong phân tử \(\mathrm{CH}_4\) còn một cặp electron chưa tham gia liên kết
Câu 21:
Cho biết chlorine (Cl có Z= 17)
Cấu hình electron lớp ngoài cùng của nguyên tử Cl là \(2 \mathrm{~s}^2 2 \mathrm{p}^5\)
Liên kết hóa học trong phân tử \(\mathrm{Cl}_2\) là liên kết cộng hóa trị không phân cực
Cl là phi kim vì có 5 e ở lớp ngoài cùng
Trong chu kỳ 7 Clo là nguyên tố có độ âm điện lớn nhất nên tính phi kim mạnh nhất
Câu 22:
Cho K có Z= 19
Cấu hình electron lớp ngoài cùng của K là \(4 \mathrm{~s}^1\)
Liên kết hóa học trong \(\mathrm{K}_2 \mathrm{O}\) là liên kết ion
Cho \(0,1 \mathrm{~mol} \mathrm{~K}\) tác dụng với \(\mathrm{H}_2 \mathrm{O}\) dư thu được 2,479 lit khí ở điều kiện chuẩn
Trong các phản ứng hóa học K có khả năng nhận thêm 1e tạo cấu hình bền của khí hiếm

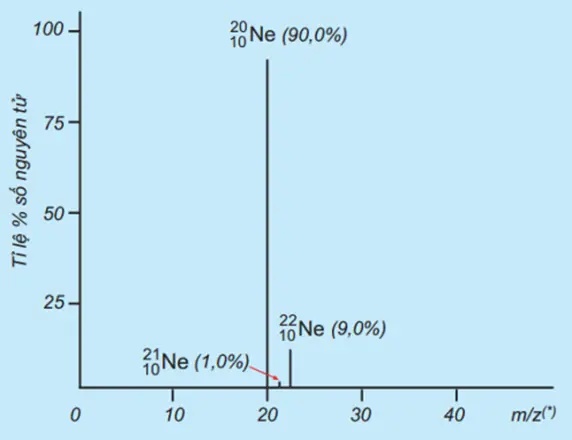 Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đòng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1). Nguyên tử khối trung bình của Neon là?
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đòng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1). Nguyên tử khối trung bình của Neon là?