Câu hỏi:
Sodium ( \({ }_{11} \mathrm{Na}\) ) và Magnesium ( \({ }_{12} \mathrm{Mg}\) ) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
Đáp án đúng: Sai, Đúng, Sai, Đúng
- \(\mathrm{Na}(\mathrm{Z}=11)\) thuộc nhóm IA (cấu hình \(\left.[\mathrm{Ne}] 3 \mathrm{~s}^1\right)\) có 1 electron hóa trị. \(\mathrm{Mg}(\mathrm{Z}=12)\) thuộc nhóm IIA (cấu hình \([\mathrm{Ne}] 3 \mathrm{~s}^2\) ) có 2 electron hóa trị. \(\Rightarrow\) a) Sai.
- Trong cùng một chu kì, đi từ trái sang phải, tính kim loại giảm dần, nên Na hoạt động hóa học mạnh hơn Mg. Mức độ phản ứng khác nhau này cho phép so sánh hoạt động hóa học. \(\Rightarrow\) b) Sai.
- Na (kim loại mạnh hơn) \(\Rightarrow \mathrm{NaOH}\) là base mạnh hơn. Mg (kim loại yếu hơn) \(\Rightarrow \mathrm{Mg}(\mathrm{OH})_2\) là base yếu hơn \(\left.\Rightarrow \mathrm{c}\right)\) Sai.
- Phản ứng giữa kim loại mạnh và phi kim mạnh luôn tạo ra hợp chất ion ( NaCl và \(\mathrm{MgCl}_2\) ). \(\Rightarrow \mathrm{d}\) ) Đúng.
Câu hỏi này thuộc đề thi trắc nghiệm dưới đây, bấm vào Bắt đầu thi để làm toàn bài
Bộ Đề Kiểm Tra Học Kì I - Hóa Học 10 - Kết Nối Tri Thức Với Cuộc Sống - Bộ Đề 01 gồm các đề luyện tập bám sát chương trình học. Nội dung bao quát các chuyên đề trọng tâm như cấu tạo nguyên tử, bảng tuần hoàn và liên kết hóa học. Các dạng câu hỏi trắc nghiệm và tự luận giúp học sinh ôn tập, củng cố kiến thức và rèn luyện kỹ năng làm bài. Bộ đề phù hợp cho việc chuẩn bị trước kỳ kiểm tra học kì I.
Câu hỏi liên quan

Trọn Bộ Giáo Án Word & PowerPoint Tiếng Anh 12 – I-Learn Smart World – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Tiếng Anh 12 – Global Success – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Hóa Học 12 – Kết Nối Tri Thức – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Hóa Học 12 – Chân Trời Sáng Tạo – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Công Nghệ 12 – Kết Nối Tri Thức – Năm Học 2025-2026

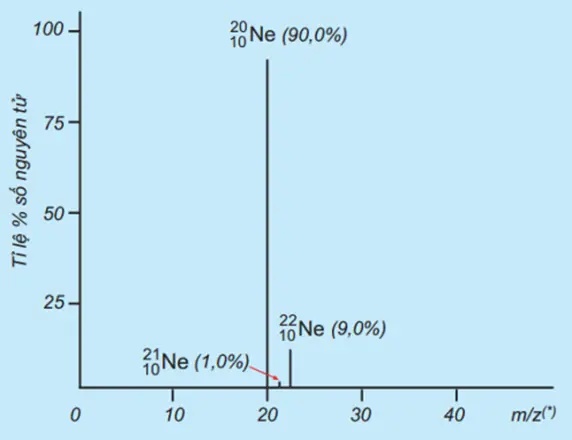 Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đòng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1). Nguyên tử khối trung bình của Neon là?
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đòng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1). Nguyên tử khối trung bình của Neon là?