10 Đề thi kiểm tra giữa HK1 môn Hóa học lớp 10 - CTST - Đề 2
28 câu hỏi 60 phút
Cho các nguyên tố hóa học: Be (Z=4), B (Z=5), Mg (Z=12), Al (Z=13) và các giá trị bán kính nguyên tử (không tương ứng): 77 pm; 80 pm; 117 pm; 125 pm. Bán kính nguyên tử của Mg là
117 pm
77 pm
125 pm
80 pm
- Be (Z=4) và B (Z=5) cùng thuộc chu kì 2 ⇒ Bán kính nguyên tử: Be > B.
- Mg (Z=12) và Al (Z=13) cùng thuộc chu kì 3 ⇒ Bán kính nguyên tử: Mg > Al.
- Be (Z=4) và Mg (Z=12) cùng thuộc nhóm IIA ⇒ Bán kính nguyên tử: Mg > Be.
⇒ Trong bốn nguyên tố Be, B, Mg, Al, nguyên tố Mg có bán kính nguyên tử lớn nhất.
⇒ Bán kính nguyên tử của Mg là 125 .
Danh sách câu hỏi:
- Be (Z=4) và B (Z=5) cùng thuộc chu kì 2 ⇒ Bán kính nguyên tử: Be > B.
- Mg (Z=12) và Al (Z=13) cùng thuộc chu kì 3 ⇒ Bán kính nguyên tử: Mg > Al.
- Be (Z=4) và Mg (Z=12) cùng thuộc nhóm IIA ⇒ Bán kính nguyên tử: Mg > Be.
⇒ Trong bốn nguyên tố Be, B, Mg, Al, nguyên tố Mg có bán kính nguyên tử lớn nhất.
⇒ Bán kính nguyên tử của Mg là 125 .
Câu 2:
Nguyên tố R là một trong các nguyên tố đa lượng cần thiết cho cây trồng. Trong hợp chất khí với hydrogen, R có hóa trị III và chiếm 82,35% về khối lượng
Oxide ứng với hóa trị cao nhất của R là \(\mathrm{R}_2 \mathrm{O}_3\)
R nằm ở nhóm VA trong bảng tuần hoàn
Hợp chất khí với hydrogen của R có mùi khai
Hydroxide tương ứng của oxide ứng với hóa trị cao nhất của R là acid yếu
- Trong hợp chất khí với hydrogen, R có hóa trị III.
⇒ Hóa trị cao nhất của R là V.
⇒ Oxide ứng với hóa trị cao nhất là \(\mathrm{R}_2 \mathrm{O}_5\)
- R nằm ở nhóm VA trong bảng tuần hoàn.
- Trong hợp chất khí với hydrogen, %mR = 82,35%.
⇒ MR = 14 (gam/mol) ⇒ R là nitrogen (N).
⇒ Hợp chất khí với hydrogen là NH3 có mùi khai.
- Oxide ứng với hóa trị cao nhất là \(\mathrm{N}_2 \mathrm{O}_5\).
⇒ Hydroxide tương ứng là HNO3 có tính acid mạnh
Câu 3:
Có hai nguyên tố X, Y thuộc cùng nhóm và ở hai chu kì liên tiếp, tổng số đơn vị điện tích hạt nhân của X và Y là 32 (ZX < ZY). Trong đó, Y đóng vai trò quan trọng đối với hệ thần kinh, đặc biệt ở người già thiếu chất này dễ bị suy nhược thần kinh, trí nhớ kém, tinh thần không ổn định, đau đầu
X có 19 electron trong nguyên tử
X và Y thuộc nhóm IIA trong bảng tuần hoàn
Nguyên tử Y có 4 lớp electron
Trong oxide ứng với hóa trị cao nhất của X, X chiếm 60% về khối lượng
Gọi số hiệu nguyên tử X và Y lần lượt là ZXvà ZY.
Ta có: ZX+ ZY= 32 (1).
Do X và Y thuộc cùng một nhóm và ở hai chu kì liên tiếp, do đó X và Y có thể cách nhau 8, 18 hoặc 32 nguyên tố.
Xét các trường hợp, nhận thấy trường hợp X và Y cách nhau nguyên tố là thỏa mãn và Y đóng vai trò quan trọng đối với hệ thần kinh, đặc biệt ở người già thiếu chất này dễ bị suy nhược thần kinh, trí nhớ kém, tinh thần không ổn định, đau đầu.
⇒ ZY= ZX+ 8, thay vào (1) được ZX= 12 suy ra ZY= 20.
X có cấu hình electron: [Ne] 3s2 (chu kì 3, nhóm IIA).
Y có cấu hình electron: [Ar] 4s2 (chu kì 4, nhóm IIA).
⇒ X là magnesium (Mg) và Y là calcium (Ca).
Câu 4:
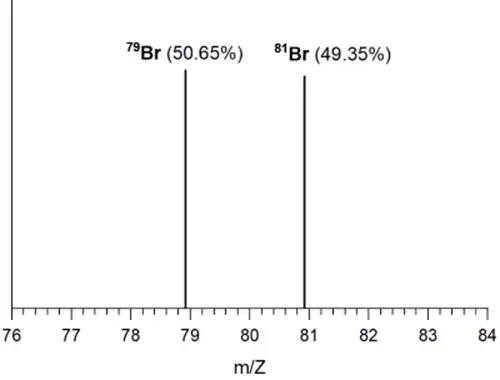
Cho phổ MS của iron (sắt) và bromine như sau:
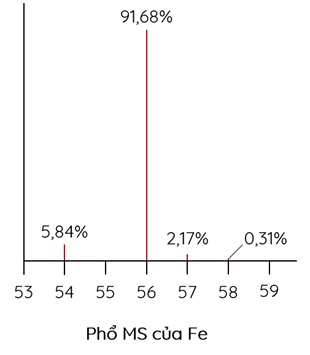
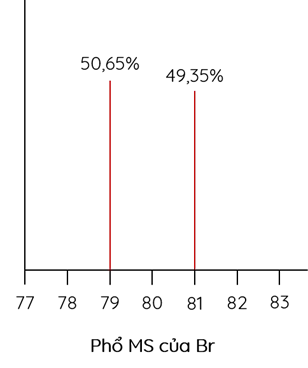
Sắt và bromine đều có hai đồng vị bền trong tự nhiên
Nguyên tử khối trung bình của sắt là 55,91
Nguyên tử khối trung bình của bromine là 79,99
Trong FeBr3, 56Fe chiếm 18,92% về khối lượng
- Từ phổ MS, ta thấy Fe có 4 đồng vị và Br có 2 đồng vị.
- Tính được nguyên tử khối trung bình của Fe và Br lần lượt là 55,91 gam/mol và 79,99 gam/mol.
- % khối lượng 56Fe trong FeBr3 là \(\%m_{_{{}}^{56}Fe}^{{}}=\frac{0,9168.56}{55,91+79,99.3}.100\%=17,35\%\)
Câu 5:
Cho thông tin về một số nguyên tử trong bảng sau:
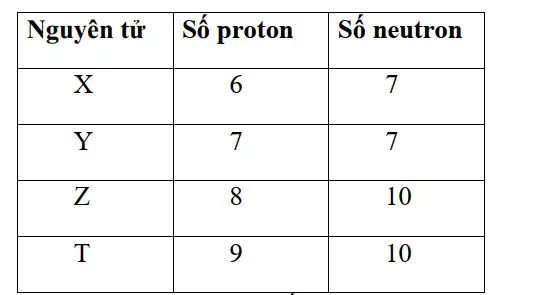
X và Y cùng thuộc một nguyên tố hóa học
Các nguyên tố X, Y, Z, T đều nằm ở chu kì 2 trong bảng tuần hoàn
Tính phi kim tăng dần theo thứ tự: X, Y, Z, T
T nguyên tố có độ âm điện lớn nhất
- X, Y có số proton khác nhau nên không thuộc cùng một nguyên tố hóa học.
- Từ cấu hình electron nguyên tử⇒ Các nguyên tố X, Y, Z, T đều thuộc chu kì 2.
- Trong một chu kì, theo chiều tăng dần điện tích hạt nhân nguyên tử, tính phi kim tăng dần.
⇒ Tính phi kim tăng dần theo thứ tự: X, Y, Z, T.
- T là nguyên tố nằm ở chu kì 2, nhóm VIIA, đây là nguyên tố có độ âm điện lớn nhất.