Trắc nghiệm Nhôm và hợp chất của nhôm Hóa Học Lớp 12
-
Câu 1:
Cho 200 ml Al2(SO4)3 tác dụng với NaOH 1M thì nhận thấy số mol kết tủa phụ thuộc vào thể tích dung dịch NaOH theo đồ thị sau:
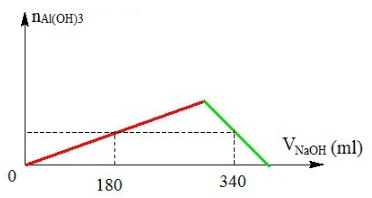
Nồng độ của dung dịch Al2(SO4)3 trong thí nghiệm trên là
A. 0,125M.
B. 0,25M.
C. 0,375M.
D. 0,50M.
-
Câu 2:
Rót từ từ Ba(OH)2 0,2M vào 150 ml AlCl3 0,04M thấy lượng kết tủa phụ thuộc vào số ml dung dịch Ba(OH)2 theo đồ thị dưới đây.
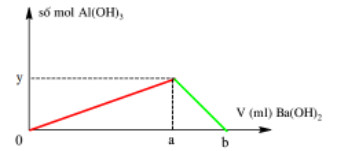
Giá trị của a và b tương ứng là:
A. 45 ml và 60 ml.
B. 45 ml và 90 ml.
C. 90 ml và 120 ml.
D. 60 ml và 90 ml.
-
Câu 3:
Dùng 100 ml dung dịch AlCl3 1M phản ứng với NaOH 0,5M nhận thấy số mol kết tủa phụ thuộc vào thể tích dung dịch NaOH theo đồ thị sau:
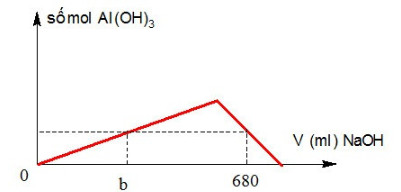
Giá trị của b là
A. 360 ml.
B. 340 ml.
C. 350 ml.
D. 320 ml.
-
Câu 4:
Cho từ từ NaOH đến dư vào dung dịch Al(NO3)3. Kết quả thí nghiệm được biểu diễn ở đồ thị dưới đây:
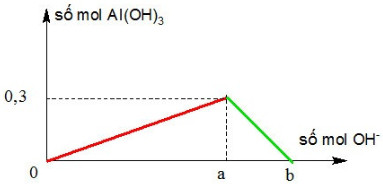
Giá trị của a, b tương ứng là
A. 0,3 và 0,6.
B. 0,6 và 0,9.
C. 0,9 và 1,2.
D. 0,5 và 0,9.
-
Câu 5:
Khi nhỏ từ từ đến dư NaOH vào dung dịch AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau (số liệu tính theo đơn vị mol):
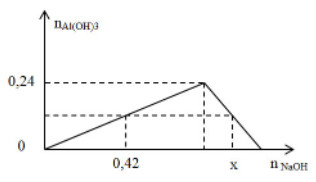
Giá trị của x là:
A. 0,82.
B. 0,86.
C. 0,80.
D. 0,84.
-
Câu 6:
Chất X chứa a mol AlCl3 và 2a mol HCl. Rót từ từ dung dịch NaOH vào dung dịch X ta có đồ thị sau:
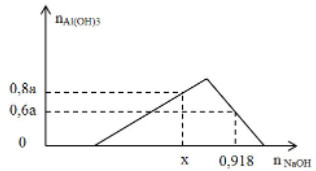
Giá trị của x là:
A. 0,756.
B. 0,624.
C. 0,684.
D. 0,748.
-
Câu 7:
Cho x gam Al tan vào dung dịch chứa y mol HCl thu được dung dịch Z chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Z thì đồ thị biểu diễn lượng kết tủa phụ thuộc vào lượng OH- như sau:
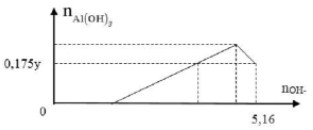
Giá trị của x là:
A. 32,4.
B. 27,0.
C. 20,2.
D. 26,1.
-
Câu 8:
Cho từ từ V ml NaOH 1M vào 200 ml dung dịch gồm HCl 0,5M và Al2(SO4)3 0,25M. Đồ thị biểu diễn khối lượng kết tủa theo V như hình dưới đây. Giá trị của a, b tương ứng là:
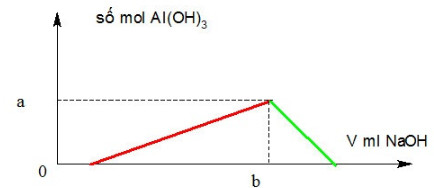
A. 0,1 và 400.
B. 0,05 và 400.
C. 0,2 và 400.
D. 0,1 và 300.
-
Câu 9:
Cho từ từ NaOH 0,5M vào 100 ml dung dịch FeCl3 aM và AlCl3 b M, thấy xuất hiện kết tủa, thấy kết tủa cực đại sau đó kết tủa hòa tan một phần. Đồ thị biểu diễn mối quan hệ giữa số mol kết tủa và số mol NaOH cho như hình vẽ:
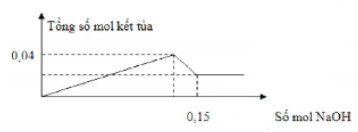
Giá trị của a và b lần lượt
A. 0,1 và 0,05.
B. 0,1 và 0,3.
C. 0,2 và 0,02.
D. 0,3 và 0,1.
-
Câu 10:
Cho m gam bột Al kim loại vào V lít dung dịch HCl 1M được dung dịch X. Cho từ từ NaOH 1M vào X, số mol kết tủa và thể tích (lít) của dung dịch NaOH được biểu diễn bằng đồ thị sau:
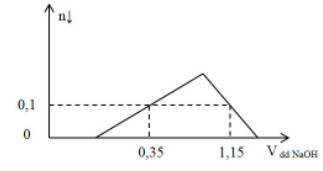
Giá trị của m và V là?
A. 8,1 và 0,95.
B. 8,1 và 0,90.
C. 6,75 và 0,95.
D. 6,75 và 0,90.
-
Câu 11:
Chất X chứa a mol HCl; a mol H2SO4 và b mol Al2(SO4)3. Rót từ từ dung dịch NaOH vào dung dịch X ta có đồ thị biểu diễn sự phụ thuộc số mol kết tủa vào số mol NaOH như sau:
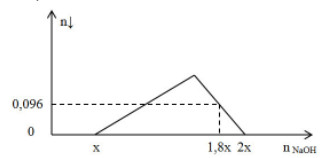
Cho dung dịch BaCl2 vào dung dịch X để kết tủa vừa hết ion SO42- thu được kết tủa và dung dịch Y chứa m gam chất tan. Giá trị của m gần nhất với giá trị nào sau đây?
A. 40.
B. 41.
C. 34.
D. 39.
-
Câu 12:
Cho hết hỗn hợp gồm Fe3O4 và Al2O3 (tỉ lệ mol 1:1) trong dung dịch chứa x mol HCl loãng, thu được dung dịch X. Cho dung dịch NaOH dư vào X, phản ứng được biểu diễn theo đồ thị sau:
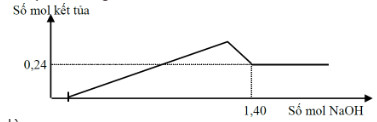
Giá trị của x là:
A. 1,12.
B. 1,24.
C. 1,20.
D. 1,18.
-
Câu 13:
Chất X có chứa các ion x mol H+, y mol Al3+, z mol SO42- và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
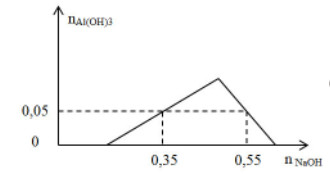
Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là (các phản ứng xảy ra hoàn toàn):
A. 62,91 gam.
B. 49,72 gam.
C. 46,60 gam.
D. 51,28 gam.
-
Câu 14:
Cho từ từ đến dư NaOH vào dung dịch chứa a mol H2SO4 và b mol Al2(SO4)3, phản ứng biểu diễn theo đồ thị sau:
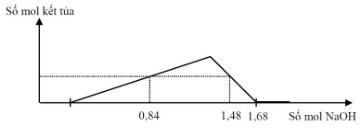
Tỉ lệ a: b là:
A. 4:3.
B. 1:2.
C. 2:3.
D. 1:3.
-
Câu 15:
Khi nhỏ NaOH vào dung dịch hỗn hợp gồm AlCl3 và FeCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
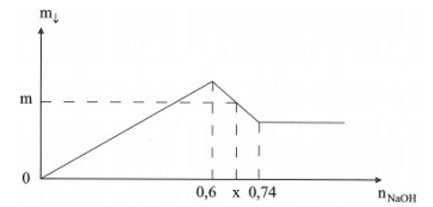
Khi x = 0,66 mol thì giá trị của m (gam) là?
A. 14,80.
B. 12,66.
C. 11,79.
D. 12,14.
-
Câu 16:
Cho X chứa AlCl3 và HCl. Chia dung dịch X thành 2 phần bằng nhau: Phần 1 cho tác dụng với dung dịch AgNO3 dư thu được 71,75 gam kết tủa. Nhỏ từ từ dung dịch NaOH vào phần 2, kết quả thí nghiệm biểu diễn bằng đồ thị sau:
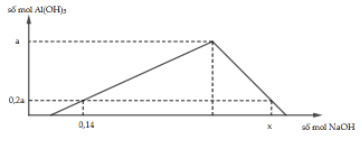
Giá trị của x là?
A. 0,57.
B. 0,51.
C. 0,33.
D. 0,62.
-
Câu 17:
Nhỏ từ từ Ba(OH)2 vào dung dịch gồm Al2(SO4)3 và AlCl3. Sự phụ thuộc khối lượng kết tủa (y gam) vào số mol Ba(OH)2 (x mol) được biểu diễn bằng đồ thị sau:
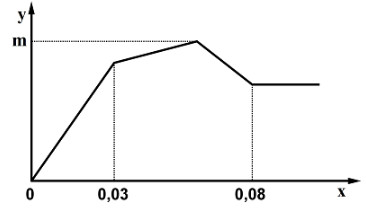
Khối lượng kết tủa cực đại là m gam. Giá trị của m là?
A. 10,11.
B. 6,99.
C. 11,67.
D. 8,55.
-
Câu 18:
Thực hiện nhiệt nhôm hỗn hợp Al, Fe2O3, Cr2O3 sau một thời gian thu được hỗn hợp chất rắn X. Chia X thành 2 phần bằng nhau. Hòa tan hoàn toàn phần 1 trong dung dịch H2SO4 đặc nóng, dư, sau khi các phản ứng xảy ra hoàn toàn, thu được 2,016 lít khí SO2 (sản phẩm khử duy nhất, đktc). Hòa tan hết phần 2 trong 400 ml dung dịch HNO3 2M, thu được dung dịch Y và khí NO (sản phẩm khử duy nhất, đktc). Cho từ từ dung dịch NaOH 1M đến dư vào Y thu được kết quả như hình vẽ sau:
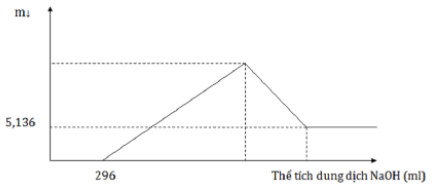
Khối lượng Cr2O3 trong hỗn hợp ban đầu là?
A. 7,29 gam.
B. 30,40 gam.
C. 6,08 gam.
D. 18,24 gam.
-
Câu 19:
Cho a mol Al vào hỗn hợp chứa b mol HCl thu được dung dịch Y chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Y ta có đồ thị sau:
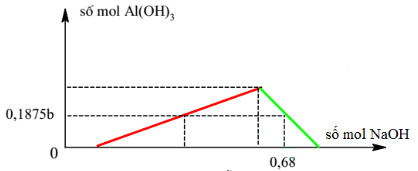
Cho a mol Al phản ứng với dung dịch hỗn hợp chứa 0,15b mol FeCl3 và 0,2b mol CuCl2. Sau khi phản ứng kết thúc thu được x gam chất rắn. Giá trị của x là:
A. 11,776.
B. 12,896.
C. 10,874.
D. 9,864.
-
Câu 20:
Cho a mol Al tan vào dung dịch chứa b mol HCl thu được Y chứa 2 chất tan có cùng nồng độ mol. Thêm từ từ dung dịch NaOH vào dung dịch Y ta có đồ thị sau:
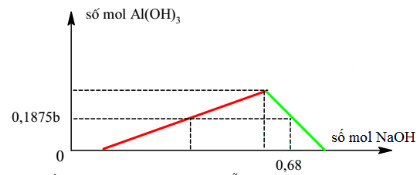
Cho a mol Al phản ứng với dung dịch hỗn hợp chứa 0,15b mol FeCl3 và 0,2b mol CuCl2. Sau khi phản ứng kết thúc thu được x gam chất rắn. Giá trị của x là:
A. 11,776.
B. 12,896.
C. 10,874.
D. 9,864.
-
Câu 21:
Hòa tan 12,060 gam hỗn hợp gồm Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1,0M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
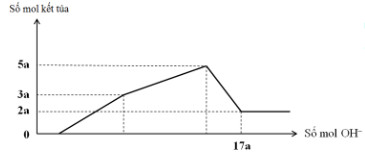
Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH)2 0,1M vào dung dịch X, thu được kết tủa lớn nhất. Lấy kết tủa nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m là:
A. 41,940.
B. 37,860.
C. 48,152.
D. 53,125.
-
Câu 22:
Trong những chất sau, chất nào không có tính lưỡng tính?
A. Al(OH)3
B. Al2O3
C. ZnSO4
D. NaHCO3
-
Câu 23:
Kim loại nhôm khử N+5 của HNO3 thành N+1. Số phân tử HNO3 đã bị khử trong pư sau khi cân bằng là:
A. 30
B. 36
C. 6
D. 15
-
Câu 24:
Một dung dịch chứa a mol AlCl3 tác dụng với một dung dịch chứa b mol NaOH. Điều kiện để thu được kết tủa là:
A. b > 4a
B. b < 4a
C. a + b = 1mol
D. a – b = 1mol
-
Câu 25:
Cho các phát biếu sau về phản ứng nhiệt nhôm:
A. Nhôm chỉ có thể khử các oxit kim loại đứng sau H trong dãy điện hoá
B. Nhôm chỉ có thể khử các oxit kim loại đứng sau Al trong dãy điện hoá
C. Nhôm chỉ có thể khử các oxit kim loại đứng trước và đứng sau Al trong dãy điện hoá với điều kiện kim loại đó dễ bay hơi
D. Nhôm khử tất cả các oxit kim loại
-
Câu 26:
Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
-
Câu 27:
Cho hỗn hợp K và Al vào H2O, thấy hỗn hợp tan hết. Chứng tỏ:
A. Nước dư
B. Nước dư và nK > nAl
C. Nước dư và nK < nAl
D. Al tan hoàn toàn trong H2O
-
Câu 28:
Cho sơ đồ phản ứng: Al → X → Al2O3 → Al
X có thể là:
A. AlCl3
B. NaAlO2
C. Al(NO3)3
D. Al2(SO4)3
-
Câu 29:
Cho các thí nghiệm sau:
1. Sục khí CO2 vào dung dịch NaAlO2
2. Sục khí NH3 vào dung dịch AlCl3.
3. Nhỏ từ từ đến dư dd HCl vào dung dịch NaAlO2.
Những thí nghiệm có hiện tượng giống nhau là:
A. 1 và 2
B. 1 và 3
C. 2 và 3
D. Cả 1, 2 và 3
-
Câu 30:
Hiện tượng nào xảy ra khi cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3?
A. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện
B. Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
C. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện, rồi tan dần.
D. Xuất hiện kết tủa keo trắng ngay lập tức và không tan
-
Câu 31:
Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là:
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
-
Câu 32:
Khi hoà tan AlCl3 vào nước, hiện tượng xảy ra là:
A. Dung dịch vẫn trong suốt
B. Có kết tủa
C. Có kết tủa đồng thời có giải phóng khí
D. Có kết tủa sau đó kết tủa tan
-
Câu 33:
Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
-
Câu 34:
Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A.
B.
C.
D.
-
Câu 35:
Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
-
Câu 36:
Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch:
A. NaOH.
B. HCl.
C. NaNO3.
D. H2SO4.
-
Câu 37:
Kim loại nhôm khử N+5 của HNO3 thành N+1. Số phân tử HNO3 đã bị khử trong pư sau khi cân bằng là
A. 30
B. 36
C. 6
D. 15
-
Câu 38:
Tại sao miếng Al (đã cạo sạch màng bảo vệ Al2O3) khử H2O rất chậm và khó, nhưng lại khử H2O dễ dàng trong dung dịch kiềm mạnh
A. Vì Al có tính khử kém hơn kim loại kiềm, kiềm thổ
B. Vì Al là kim loại có thể tác dụng với dung dịch kiềm
C. Vì Al tạo lớp màng bảo vệ Al(OH)3. Lớp màng bị tan trong dung dịch kiềm mạnh
D. Vì Al là kim loại có hiđrôxit lưỡng tính.
-
Câu 39:
Có 4 dung dịch muối riêng biệt: CuCl2, ZnCl2, FeCl3, AlCl3. Nếu thêm dung dịch KOH (dư) rồi thêm tiếp dung dịch NH3 (dư) vào 4 dung dịch trên thì số chất kết tủa thu được là
A. 4
B. 1
C. 3
D. 2
-
Câu 40:
Cho bột Al vào dung dịch KOH dư, ta thấy hiện tượng?
A. Sủi bọt khí, bột Al không tan hết và thu được dung dịch không màu.
B. Sủi bọt khí, Al không tan hết và dung dịch màu xanh lam.
C. Sủi bọt khí, Al tan dần đến hết và thu được dung dịch không màu.
D. Sủi bọt khí, bột Al tan dần đến hết và thu được dung dịch màu xanh lam.
-
Câu 41:
Trong những chất sau, chất nào không có tính lưỡng tính?
A. Al(OH)3
B. Al2O3
C. NaHCO3
D. ZnSO4
-
Câu 42:
Cho dd NH3 dư vào dd AlCl3 và ZnCl2 thu được A. Nung A được chất rắn B. Cho luồng H2 đi qua B nung nóng sẽ thu được chất rắn:
A. Zn và Al
B. Zn và Al2O3
C. ZnO và Al2O3
D. Al2O3
-
Câu 43:
Kim loại nào sau đây được dùng nhiều nhất để đóng gói thực phẩm:
A. Zn
B. Fe
C. Sn
D. Al
-
Câu 44:
Trong các kim loại sau: Cu, Fe, Pb, Al người ta thường dùng kim loại nào để làm vật liệu dẫn điện hay dẫn nhiệt.
A. Chỉ có Cu
B. Cu và Al
C. Fe và Al
D. Chỉ có Al
-
Câu 45:
Cho dd NH3 dư vào dd AlCl3 và ZnCl2 thu được A. Nung A được chất rắn B. Cho luồng H2 đi qua B nung nóng sẽ thu được chất rắn:
A. Zn và Al
B. Zn và Al2O3
C. ZnO và Al2O3
D. Al2O3
-
Câu 46:
Tại sao miếng Al (đã cạo sạch màng bảo vệ Al2O3) khử H2O rất chậm và khó, nhưng lại khử H2O dễ dàng trong dung dịch kiềm mạnh
A. Vì Al có tính khử kém hơn kim loại kiềm, kiềm thổ
B. Vì Al là kim loại có thể tác dụng với dung dịch kiềm
C. Vì Al tạo lớp màng bảo vệ Al(OH)3. Lớp màng bị tan trong dung dịch kiềm mạnh
D. Vì Al là kim loại có hiđrôxit lưỡng tính.
-
Câu 47:
Hiện tượng nào sau đây là đúng.
A. Nhỏ từ từ dung dịch KOH vào dung dịch Al2(SO4)3 đến dư, lượng vừa xuất hiện, lắc tan, sau một thời gian lại xuất hiện nhiều dần
B. Nhỏ từ từ dd HCl vào dd NaAlO2 cho đến dư, lượng xuất hiện nhiều dần, sau đó tan từ từ và mất hẳn
C. Sục luồng khí CO2 từ từ vào dung dịch NaAlO2, xuất hiện, sau đó tan dần do khí CO2 có dư
D. Cho một luồng khí CO2 từ từ vào nước vôi trong, xuất hiện nhiều dần và không tan trở lại ngay cả khi CO2 có dư
-
Câu 48:
Trong công nghiệp, người ta điều chế nhôm bằng phương pháp
A. Cho Mg đẩy Al ra khỏi dung dịch AlCl3
B. Khử Al2O3 bằng
C. Điện phân nóng chảy AlCl3
D. Điện phân nóng chảy Al2O3
-
Câu 49:
Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch:
A. NaOh
B. HCl
C. NaNO3
D. H2SO4
-
Câu 50:
Al2O3 phản ứng được với cả hai dung dịch
A. NaOH và HCl.
B. KCl và NaNO3.
C. NaCl và H2SO4.
D. Na2SO4 và KOH.














