Cho từ từ đến dư NaOH vào dung dịch chứa a mol H2SO4 và b mol Al2(SO4)3, phản ứng biểu diễn theo đồ thị sau:
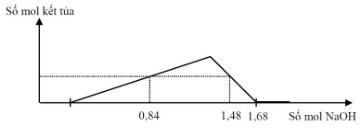
Tỉ lệ a: b là:
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo saiTa có: nH+ = 2a mol; nAl3+ = 2b mol
Khi nOH- = 0,84 mol: Kết tủa chưa đạt cực đại: nOH- = nH+ + 3.nAl(OH)3
⟹ 0,84 = 2a + 3.nAl(OH)3 ⟹ nAl(OH)3 = \({{0,84 - 2a} \over 3}\) mol (1)
Khi nOH- = 1,48 mol: Kết tủa đang bị hòa tan một phần: nOH- = nH+ + 4.nAl3+ - nkết tủa
⟹1,48 = 2a + 4.2b - nAl(OH)3 = 2a + 8b - nAl(OH)3 (2)
Khi nOH- = 1,68 mol: Kết tủa bị hòa tan hoàn toàn: nOH- = nH+ + 4.nAl3+
⟹ 1,68 = 2a + 4.2b = 2a + 8b (3)
Thay 2a + 8b = 1,68 vào (2) ta suy ra nAl(OH)3 = 1,68 - 1,48 = 0,2 mol
Thay vào (1) ta suy ra nAl(OH)3 = \({{0,84 - 2a} \over 3}\) = 0,2 mol → a = 0,12
Thay vào (3) suy ra b = 0,18 mol
Vậy a : b = 0,12 : 0,18 = 2 : 3.