Đề thi thử THPT QG năm 2022 môn Hóa học
Trường THPT Yên Lạc 2
-
Câu 1:
Để khắc chữ lên thủy tinh người ta dùng phản ứng nào sau đây?
A. SiO2 + Mg → 2MgO + Si
B. SiO2 + 4HF → SiF4 + 2H2O
C. SiO2 + 2NaOH → Na2SiO3 + CO2
D. SiO2 + Na2CO3 → Na2SiO3 + CO2
-
Câu 2:
Trong phương pháp thủy luyện dùng để điều chế Ag từ quặng có chứa Ag2S. Hóa chất cần dùng là :
A. Dung dịch HNO3 đặc và Zn
B. Dung dịch H2SO4 đặc nóng và Zn
C. Dung dịch NaCN và Zn
D. Dung dịch HCl và Zn
-
Câu 3:
Protein phản ứng với Cu(OH)2 tạo ra sản phẩm có màu đặc trưng :
A. Màu đỏ
B. Màu cam
C. Màu vàng
D. Màu tím
-
Câu 4:
Oxi hóa NH3 bằng CrO3 sinh ra N2 , H2O và Cr2O3. Số phân tử NH3 tác dụng với 1 phân tử CrO3 là :
A. 4
B. 2
C. 3
D. 1
-
Câu 5:
Nhôm không tan trong dung dịch
A. HCl
B. NaOH
C. NaHSO4
D. Na2SO4
-
Câu 6:
Trong thành phần của gang, nguyên tố chiếm thành phần cao nhất là
A. Si
B. C
C. S
D. Fe
-
Câu 7:
Cho dung dịch Na2CO3 vào dung dịch Ca(HCO3)2 thấy :
A. Có bọt khí thoát ra
B. Có kết tủa trắng và bọt khí
C. Có kết tủa trắng
D. Không có hiện tượng gì
-
Câu 8:
Dân gian xưa kia dùng phèn chua làm thuốc chữa đau răng, đau mắt, cầm máu và đặc biệt dùng làm trong nước. Nguyên nhân nào sau đây làm cho phèn chua có khả năng làm trong nước
A. Phèn chua có tính axit nên hút hết hạt bẩn lơ lửng trong nước về phía mình , làm trong nước
B. Phèn chua bị điện ly tạo ra các ion K+ , Al3+, SO42- nên các ion này hút hết hạt bẩn lơ lửng về phía mình, làm trong nước
C. Khi hòa tan vào nước , do quá trình điện ly và thủy phân Al3+ tạo ra Al(OH)3 dạng keo nên hút các hạt bẩn lơ lửng về phía mình, làm trong nước
D. Phèn chua bị điện ly thành K+, SO42- trung tính nên hút các hạt bẩn lơ lửng làm trong nước.
-
Câu 9:
Phản ứng giữa C2H5OH và CH3COOH (xúc tác H2SO4 đặc đun nóng) là phản ứng
A. Trùng hợp
B. Este hóa
C. Xà phòng hóa
D. Trùng ngưng
-
Câu 10:
Phản ứng nào sau đây giải thích cho hiện tượng “nước chảy, đá mòn”?
A. CaCO3 + CO2 + H2O → Ca(HCO3)2.
B. Ca(HCO3)2 → CaCO3 + CO2 + H2O.
C. CaO + CO2 → CaCO3.
D. CaO + H2O → Ca(OH)2.
-
Câu 11:
Người ta có thể bảo vệ vỏ tàu biển bằng cách gắn những tấm kẽm vào vỏ tàu ở phần chìm trong nước biển (nước biển là dung dịch chất điện ly) vì
A. Thép là cực dương, không bị ăn mòn, kẽm là cực âm, bị ăn mòn
B. Thép là cực âm, không bị ăn mòn, kẽm là cực dương, bị ăn mòn
C. Kẽm gắn tiếp xúc với nước biển nên thép không thể tác dụng được với nước
D. Kẽm gắn tiếp xúc với nước biển nên thép không thể tác dụng được với các chất có trong nước biển
-
Câu 12:
Nhóm vật liệu vào được chế tạo từ polime thiên nhiên
A. Nhựa bakelit, tơ tằm, tơ axetat
B. Cao su isopren, nilon-6,6 , keo dán gỗ
C. Tơ visco, cao su buna, keo dán gỗ
D. Tơ visco, tơ tằm, phim ảnh
-
Câu 13:
Hỗn hợp M gồm axit cacboxylic X, ancol Y (đều đơn chức) và este Z được tạo ra từ X và Y (trong M , oxi chiếm 43,795% về khối lượng). Cho 10,96g M tác dụng vừa đủ với 40g dung dịch NaOH 10% tạo ra 9,4g muối. Công thức của X và Y lần lượt là ?
A. CH2=CHCOOH và C2H5OH
B. CH2=CHCOOH và CH3OH
C. C2H5COOH và CH3OH
D. CH3COOH và C2H5OH
-
Câu 14:
Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ :
A. vàng sang vàng cam
B. không màu sang vàng cam
C. không màu sang vàng
D. vàng cam sang vàng
-
Câu 15:
Khí cacbonic chiếm 0,03% thể tích không khí. Muốn tạo ra 500 g tinh bột thì cần bao nhiêu lit không khí (dktc) để cung cấp đủ CO2 cho phản ứng quang hợp
A. 1 482 600 lit
B. 1 382 600 lit
C. 1 402 666 lit
D. 1 382 716 lit
-
Câu 16:
Cho Glixerol tác dụng với axit axetic thì có thể sinh ra tối đa bao nhiêu chất có chứa gốc este ?
A. 2
B. 6
C. 5
D. 4
-
Câu 17:
Điều chế kim loại K bằng phương pháp nào?
A. Dùng khí CO khử ion K+ trong K2O ở nhiệt độ cao
B. Điện phân dung dịch KCl không có màng ngăn
C. Điện phân dung dịch KCl có màng ngăn
D. Điện phân KCl nóng chảy
-
Câu 18:
Amilozo được tạo thành từ gốc
A. -Glucozo
B. -Glucozo
C. -Fructozo
D. -Fructozo
-
Câu 19:
Cho dãy kim loại : Zn, Fe, Cr. Thứ tự giảm dần độ hoạt động hóa học của các kim loại từ trái sang phải là :
A. Zn, Fe, Cr
B. Fe, Zn, Cr
C. Zn, Cr, Fe
D. Cr, Fe, Zn
-
Câu 20:
Phương trình 2H+ + S2- → H2S là phương trình rút gọn của phản ứng:
A. 2HCl + K2S → 2KCl + H2S.
B. FeS + 2HCl → FeCl2 + H2S.
C. BaS + H2SO4 → BaSO4 + H2S.
D. 2HCl + CuS → CuCl2 + H2S.
-
Câu 21:
Cho 38,55g hỗn hợp X gồm Mg, Al, ZnO và Fe(NO3)2 tan hoàn toàn trong dung dịch chứa 0,725 mol H2SO4 loãng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa 96,55g muối sunfat trong hòa và 3,92 lit khí Z (dktc) gồm 2 khí trong đó có 1 khí hóa nâu ngoài không khí. Biết tỉ khối của Z so với H2 là 9. Phần trăm số mol Mg trong hỗn hợp X gần nhất với giá trị nào sau đây :
A. 25
B. 15
C. 40
D. 30
-
Câu 22:
Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Mg trong V ml dung dịch HNO3 2,5M. Kết thúc phản ứng thu được dung dịch X (không chứa muối amoni) và 0,084 mol hỗn hợp khí N2 và N2O có tỉ khối so với oxi là 31:24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ bên.
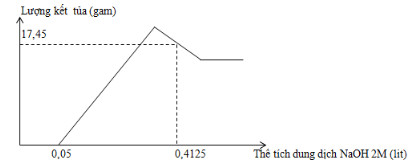
Giá trị của m và V lần lượt là
A. 6,36 và 378,2.
B. 7,5 và 250,0.
C. 6,36 và 250,0.
D. 7,5 và 387,2.
-
Câu 23:
Cho m gam hỗn hợp X gồm Na, Ca tan hết trong dung dịch Y chứa 0,08 mol NaHCO3 và 0,04 mol CaCl2. Sau phản ứng thu được 7g kết tủa và thấy thoát ra 0,896 lit khí (dktc). Giá trị của m là?
A. 1,2
B. 1,56
C. 1,72
D. 1,66
-
Câu 24:
Hỗn hợp A chứa 3 ankin với tổng số mol là 0,1 mol. Chia A thành 2 phần bằng nhau. Đốt cháy hoàn toàn phần 1, thu 2,34g nước . Phần 2 tác dụng với vừa đủ 250 ml dung dịch AgNO3 0,12M trong NH3 tạo ra 4,55g kết tủa . Hãy gọi tên và phần trăm khối lượng của từng chất trong hỗn hợp A, biết rằng ankin có phân tử khối nhỏ nhất chiếm 40% về số mol.
A. Propin 33,1% ; but – 1 – in 22,3% ; but – 2 – in 44,6%
B. Etin 22,3 % ; propin 33,1% ; but – 2 – in 44,6%
C. Etin 22,3 % ; propin 33,1% ; but – 1 – in 44,6%
D. Propin 33,1% ; but – 2 – in 22,3% ; but – 1 – in 44,6%
-
Câu 25:
Chất A có công thức phân tử C6H8O4 .Cho sơ đồ phản ứng sau :
(A) + 2NaOH → (B) + (C) + H2O
(B) (D) + H2O
(C) + HCl → (E) + NaCl
Phát biểu nào sau đây phù hợp với sơ đồ trên :
A. Chất E là HOOC-CH≡CH-COOH
B. Chất B là CH3OH
C. Chất D là C3H6
D. Chất A là este 2 chức
-
Câu 26:
Hỗn hợp X gồm chất A (C5H16O3N2) và chất B (C4H12O4N2) tác dụng với dung dịch NaOH vừa đủ đung nóng cho đến khi phản ứng xảy ra hoàn toàn rồi cô cạn thu được m gam hỗn hợp Y gồm 2 muối D và E (MD < ME) và 4,48 lit khí (dktc) hỗn hợp Z gồm 2 amin no đơn chức đồng đẳng kế tiếp có tỉ khối so với H2 bằng 18,3. Khối lượng của muối E trong hỗn hợp Y là :
A. 4,24
B. 3,18
C. 5,36
D. 8,04
-
Câu 27:
Khử hoàn toàn hỗn hợp gồm m gam FeO, Fe2O3, Fe3O4 bằng CO dư ở nhiệt độ cao. Sau phản ứng thu được 33,6 g chất rắn. Dẫn hỗn hợp khí sau phản ứng vào dung dịch Ca(OH)2 dư thu được 80g kết tủa. Giá trị của m là?
A. 34,88
B. 36,16
C. 46,4
D. 59,2
-
Câu 28:
Cho các phát biểu sau
(1) Tất cả các amino axit đều là chất rắn điều kiện thường
(2) Tất cả các amino axit đều không làm đổi màu quì tím
(3) Glyxin phản ứng được với tất các chất sau : dung dịch NaOH, dung dịch H2SO4
(4) Tất cả các amino axit đều có khả năng trùng hợp tạo peptit(
5) Có thể dùng quì tím để phân biệt các dung dịch alanin, lysin, axit glutamic
(6) Trong phân tử amino axit vừa chứa liên kết cộng hóa trị, vừa chứa liên kết ion
Số phát biểu đúng là :
A. 3
B. 4
C. 6
D. 5
-
Câu 29:
Trong phân tử este đa chức mạch hở X có 2 liên kết p, số nguyên tử cacbon và oxi khác nhau là 2. Cho X tác dụng với dung dịch NaOH, thu được sản phẩm gồm 1 muối của axit cacboxylic Y và một ancol Z. Biết X không có phản ứng tráng bạc . Số công thức cấu tạo phù hợp của X là
A. 5
B. 4
C. 3
D. 6
-
Câu 30:
Hỗn hợp X gồm M2CO3 , MHCO3 và MCl (trong đó M là kim loại kiềm). Nung nóng 20,29g hỗn hợp X, sau phản ứng xảy ra hoàn toàn thấy còn lại 18,74g chất rắn. Cũng đem 20,29g hỗn hợp X tác dụng hết với 500 ml dung dịch HCl 1M thì thoát ra 3,36 lit khí (dktc) và dung dịch Y. Cho Y tác dụng với dung dịch AgNO3 dư thu được 74,62g kết tủa . Kim loại M là?
A. Na
B. Li
C. K
D. Cs
-
Câu 31:
Cho các chất mạch hở : X là axit không no mạch phân nhánh, có 2 liên kết p ; Y và Z là 2 axit no đơn chức ; T là ancol no 3 chức ; E là este của X, Y, Z với T. Đốt cháy hoàn toàn m gam hỗn hợp M gồm X và E thu được a gam CO2 và (a – 4,62) gam H2O, mặt khác m gam M phản ứng vừa đủ với 0,04 mol NaOH trong dung dịch. Cho 13,2 gam M phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp muối khan V. Đốt cháy hoàn toàn V thu được 0,4 mol CO2 và 14,24 gam gồm Na2CO3 và H2O. Phần trăm khối lượng của E trong M có giá trị gần nhất với:
A. 92,4
B. 34,8
C. 73,9
D. 69,7
-
Câu 32:
Hòa tan hoàn toàn 2 chất rắn X, Y (số mol bằng nhau) vào nước thu được dung dịch Z.
Tiến hành các thí nghiệm sau:
- Thí nghiệm 1: Cho dung dịch NaOH dư vào V ml dung dịch Z thu được n1 mol kết tủa
- Thí nghiệm 2: Cho dung dịch NH3 dư vào V ml dung dịch X thu được n2 mol kết tủa
- Thí nghiệm 3: Cho dung dịch AgNO3 dư vào V ml dung dịch Z thu được n3 mol kết tủaBiết các phản ứng xảy ra hoàn toàn và n1 = n2 < n3.
Hai chất X, Y không thể là :
A. ZnCl2 ; FeCl2
B. Al(NO3)3 ; Fe(NO3)2
C. FeCl2 ; FeCl3
D. FeCl2 ; Al(NO3)3
-
Câu 33:
Điện phân V lit dung dịch X (điện cực trơ, màng ngăn xốp , cường độ dòng điện không đổi) chứa đồng thời R(NO3)2 0,45M (R là kim loại có hóa trị không đổi) và NaCl 0,4M trong thời gian t(giây) thu được 5,376 lit hỗn hợp khí ở anot (dktc). Nếu thời gian điện phân là 2t (giây) thì thu được dung dịch Y. Dung dịch Y tác dụng vừa đủ với 320 ml dung dịch chứa KOH 0,75M và NaOH 0,5M, không sinh ra kết tủa . Biết hiệu suất điện phân 100%. Các khí sinh ra không tan trong dung dịch. Giá trị của V là
A. 0,60
B. 0,80
C. 0,40
D. 1,60
-
Câu 34:
Đốt cháy X cũng như Y với lượng oxi vừa đủ luôn thu được CO2 có số mol bằng số mol O2 đã phản ứng. Biết rằng X, Y (MX < MY) là 2 este đều mạch hở không phân nhánh và không chứa nhóm chức khác . Đun nóng 30,24g hỗn hợp E chứa X, Y (số mol của X gấp 1,5 lần số mol Y) cần dùng 400 ml dung dịch KOH 1M, thu được hỗn hợp F chứa 2 ancol và hỗn hợp chứa 2 muối. Dẫn toàn bộ F qua bình dựng Na dư thấy khối lượng bình tăng 15,2g. Đốt cháy hoàn toàn hỗn hợp muối cần dùng 0,42 mol O2. Tổng số nguyên tử có trong 1 phân tử Y là?
A. 21
B. 20
C. 22
D. 19
-
Câu 35:
Tiến hành thí nghiệm của 1 vài vật liệu polime với dung dịch kiềm theo các bước sau đây
- Bước 1 : Lấy 4 ống nghiệm đựng lần lượt các chất PE, PVC , sợi len, xenlulozo theo thứ tự 1,2,3,4
- Bước 2 : Cho vào mỗi ống nghiệm 2 ml dung dịch NaOH 10% đun sôi, để nguội
- Bước 3 : Gạt lấy lớp nước ở mỗi ống nghiệm ta được tương ứng là các ống nghiệm 1’,2’,3’,4’
- Bước 4 : Thêm HNO3 và vài giọt AgNO3 vào ống nghiệm 1’,2’. Thêm vài giọt CuSO4 vào ống 3’,4’.
Phát biểu nào sau đây sai :
A. Ống 1’ không hiện tượng
B. Ống 2’ có kết tủa trắng
C. Ống 3’ có màu tím đặc trưng
D. Ống 4’ có màu xanh lam
-
Câu 36:
Hòa tan hoàn toàn 16,4g hỗn hợp X gồm FeO, Fe3O4 , Cu (trong đó FeO chiếm 1/3 tổng số mol hỗn hợp X) trong dung dịch NaNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,896 lit NO (sản phẩm khử duy nhất của N+5, dktc). Mặt khác hòa tan hoàn toàn 16,4g hỗn hợp X trên trong dung dịch HCl thu được dung dịch Z chỉ chứa 3 muối có tổng khối lượng là 29,6g. Trộn dung dịch Y với dung dịch Z thì thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào dung dịch T thu được m gam kết tủa . Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với
A. 196,35
B. 111,27
C. 160,71
D. 180,15
-
Câu 37:
Cacbohidrat nào không tác dụng với H2 ( Xúc tác Ni, to ) ?
A. Saccarozo
B. Fructozo
C. Glucozo
D. Axit glutamic
-
Câu 38:
Kim loại nào chỉ được điều chế từ phương pháp điện phân nóng chảy?
A. K
B. Cu
C. Ni
D. Ag
-
Câu 39:
Aminoaxit nào sau đây có phân tử khối bé nhất
A. Valin
B. Alanin
C. Glyxin
D. Axit glutamic
-
Câu 40:
Trung hòa 11,8 g một amin đơn chức cần 200 ml dung dịch HCl 1M. CTPT của X là?
A. C3H9N
B. CH5N
C. C2H5N
D. C3H7NH2














