Đề thi thử THPT QG môn Hóa học năm 2019
Trường THPT Chuyên KHTN lần 1
-
Câu 1:
Ở điều kiện thường, kim loại nào sau đây tác dụng với bột lưu huỳnh?
A. Fe.
B. Hg.
C. Cr.
D. Cu.
-
Câu 2:
Dung dịch chứa Ala-Gly-Ala không phản ứng được với dung dịch nào sau đây?
A. HCl.
B. Mg(NO3)2.
C. KOH.
D. NaOH.
-
Câu 3:
Kim loại nào sau đây là kim loại kiềm thổ?
A. Na
B. Ca
C. Al
D. Fe
-
Câu 4:
Poli(vinyl clorua) là chất cách điện tốt, được dùng làm vật liệu cách điện, ống dẫn nước...Monome được dùng để điều chế PVC là
A. CF2=CH2.
B. CH2=CH-CH2Cl.
C. CH2=CHCl.
D. CH2=CCl2.
-
Câu 5:
Trong công nghiệp đường, chất khí X được dùng để tảy màu cho dung dịch nước đường trong dây truyền sản xuất saccarozơ. X là
A. CO2
B. CO
C. SO2
D. Cl2.
-
Câu 6:
Etyl isovalerat là este có mùi thơm của táo. Công thức cấu tạo thu gọn của etyl isovalerat là
A. CH3-CH2-CH2-CH2-COO-C2H5.
B. (CH3)2CH-COO-C2H5.
C. (CH3)2CH-CH2-COO-C2H5.
D. C2H3-COO-CH2-CH2-CH(CH3)2.
-
Câu 7:
Nhỏ dung dịch NaOH loãng vào bình đựng dung dịch chất X, thu được kết tủa màu xanh nhạt.Khi thêm tiếp dung dịch NaOH vào bình, thấy kết tủa tan dần tạo thành dung dịch màu lục nhạt. X là
A. CrCl3.
B. AlCl3.
C. CuCl2.
D. ZnCl2.
-
Câu 8:
Đốt cháy hoàn toàn amin X no, đơn chức, mạch hở, thu được 8,96 lít CO2 (đktc) và 0,1 mol N2. Công thức phân tử của X là
A. C2H7N.
B. C4H11N.
C. C2H5N.
D. C4H9N.
-
Câu 9:
Kim loại nhôm không tan được trong dung dịch nào sau đây?
A. NaOH.
B. H2SO4 đặc nguội.
C. HCl.
D. Ba(OH)2.
-
Câu 10:
Chất nào sau đây thuộc loại đisaccarit?
A. Saccarozơ.
B. Xenlulozơ.
C. Tinh bột.
D. Glucozơ.
-
Câu 11:
Oxit nào sau đây phản ứng với H2O ở điều kiện thường?
A. Fe2O3.
B. CrO3.
C. SiO2.
D. N2O.
-
Câu 12:
Cho các chất sau: đimetylamin, axit glutamic, phenyl amoni clorua, natri axetat. Số chất phản ứng được với dung dịch HCl là
A. 3
B. 4
C. 2
D. 1
-
Câu 13:
Kim loại nào sau đây có thể được điều chế bằng phương pháp nhiệt luyện?
A. Na.
B. Al.
C. Ca.
D. Fe.
-
Câu 14:
Trong các chất sau, chất nào là chất rắn, không màu, dễ tan trong nước, kết tinh ở điều kiện thường?
A. C6H5NH2.
B. NH2-CH2-COOH.
C. Mg(OH)2.
D. (C6H10O5)n.
-
Câu 15:
X và Y là hai kim loại phản ứng được với dung dịch HCl nhưng không tác dụng được với dung dịch Fe(NO3)2. X, Y là
A. Mg, Zn.
B. Mg, Fe.
C. Fe, Cu.
D. Fe, Ni.
-
Câu 16:
Trong các chất sau đây, chất nào có trạng thái khác với các chất còn lại ở điều kiện thường?
A. Metyl aminoaxtat.
B. Alanin.
C. Axit glutamic.
D. Valin.
-
Câu 17:
Thạch cao nung được dùng để bó bột, đúc tượng do có hiện tượng giãn nở thể tích khi đông cứng. Thành phần chính của thạch cao nung chứa
A. CaSO4.
B. CaSO4.2H2O.
C. CaSO4.H2O.
D. Ca(HCO3)2.
-
Câu 18:
Chất hữu cơ X mạch hở, có công thức C4H6O2. Khi đun X với dung dịch KOH thu được muối Y, biết MX < MY. Số công thức cấu tạo của X là
A. 5
B. 6
C. 4
D. 3
-
Câu 19:
Cho 16,8 gam Fe vào 200 ml dung dịch CuSO4 0,75M. Sau một thời gian lấy thanh sắt ra cân nặng 17,6 gam. Khối lượng Cu bám trên thanh sắt là
A. 19,2.
B. 6,4.
C. 0,8.
D. 9,6.
-
Câu 20:
Lên men m gam glucozơ (hiệu suất 75%) thành ancol etylic và khí CO2. Dẫn toàn bộ lượng CO2 này vào bình đựng nước vôi trong thấy tách ra 40 gam kết tủa và dung dịch X. Thêm từ từ dung dịch NaOH vào dung dịch X đến khi lượng kết tủa tối đa thì dừng lại và sử dụng hết 0,04 mol NaOH. Giá trị của m là
A. 45,0.
B. 52,8.
C. 57,6.
D. 43,2.
-
Câu 21:
X là dung dịch HCl nồng độ xM, Y là dung dịch Na2CO3 nồng độ yM. Nhỏ từ từ 100 ml dung dịch X vào 100 ml dung dịch Y, sau các phản ứng thu được V1 lít CO2 (đktc). Nhỏ từ từ 100 ml dung dịch Y vào 100 ml dung dịch X, sau phản ứng thu được V2 lít CO2 (đktc). Biết tỉ lệ V1 : V2 = 4 : 7. Tỉ lệ x : y bằng
A. 5 : 3.
B. 10 : 7.
C. 7 : 5.
D. 7 : 3.
-
Câu 22:
Hai chất P, Q có công thức phân tử lần lượt là C3H12N2O3 và C2H7NO3. Khi cho P, Q phản ứng với dung dịch HCl cùng tạo ra khí Z, còn với dung dịch NaOH cùng tạo khí Y. Nhận xét nào sau đây đúng?
A. MY < MZ.
B. Khí Z làm xanh giấy quỳ ấm.
C. MY > MZ.
D. Khí Y làm đỏ giấy quỳ ẩm.
-
Câu 23:
Cho một lượng hợp kim Ba - Na vào 200 ml dung dịch X gồm HCl 0,1M và CuCl2 0,1M. Kết thúc các phản ứng, thu được 0,448 lít khí (đktc) và m gam kết tủa. Giá trị của m là
A. 1,28.
B. 0,64.
C. 0,98.
D. 1,96.
-
Câu 24:
Đốt cháy hoàn toàn V lít hỗn hợp khí X gồm H2, CH4, C2H6, C3H8 và C4H10 thu được 7,84 lít CO2 và 9,9 gam H2O, các khí đo ở đktc. Giá trị của V là
A. 3,36.
B. 4,48.
C. 5,6.
D. 6,72.
-
Câu 25:
Thực hiện các thí nghiệm sau ở nhiệt độ thường
(1) Cho bột Al vào dung dịch NaOH.
(2) Cho bột Fe vào dung dịch AgNO3.
(3) Cho CaO vào dung dịch CH3COOH.
(4) Cho dung dịch AgNO3 vào dung dịch AlCl3.
Số thí nghiệm có xảy ra phản ứng là
A. 4
B. 2
C. 3
D. 1
-
Câu 26:
Cho 10 ml dung dịch ancol etylic 46° phản ứng hết với kim loại Na (dư), thu được V lít khí H2 (đktc). Biết khối lượng riêng của ancol etylic nguyên chất và H2O lần lượt bằng 0,8 g/ml và 1 g/ml. Giá trị của V là
A. 0,896.
B. 3,36.
C. 1,95.
D. 4,256.
-
Câu 27:
Cho các chất rắn sau: Cr2O3, Fe(NO3)2, Al(OH)3, Mg. Số chất tan được trong dung dịch HCl loãng, nguội là
A. 1
B. 2
C. 3
D. 4
-
Câu 28:
X là axit đơn chức, mạch hở. Y là ancol đơn chức, mạch hở. Đun nóng hỗn hợp X, Y với H2SO4 đặc thu được este Z. Biết trong Z có chứa 54,54% khối lượng C. Số cặp chất phù hợp với X, Y là
A. 4
B. 3
C. 2
D. 1
-
Câu 29:
Cho V lít (đktc) hỗn hợp khí CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
A. 0,224.
B. 0,448.
C. 0,112.
D. 0,560.
-
Câu 30:
Hợp chất hữu cơ A có công thức phân tử C9H8O4 thỏa mãn các phương trình hóa học sau:
(1) A + 3NaOH → 2X + Y + H2O;
(2) 2X + H2SO4 → Na2SO4 + 2Z
(3) Z + 2AgNO3 + 4NH3 + H2O → T + 2Ag + 2NH4NO3
Nhận xét nào sau đây đúng:
A. Phân tử A có 4 liên kết π.
B. Sản phẩm của (1) có 1 muối duy nhất.
C. Phân tử Y có 7C.
D. Phân tử Y có 3O.
-
Câu 31:
Hỗn hợp X gồm ba triglixerit được tạo bởi axit oleic và axit linoleic (có tỉ lệ mol tương ứng của hai axit là 2 : 1). Đốt cháy hoàn toàn a gam X thu được 37,752 gam CO2 và 13,77 gam H2O. Mặt khác, hiđro hóa hoàn toàn a gam X thu được chất hữu cơ Y. Đun Y với dung dịch KOH (vừa đủ) thu được glixerol và m gam muối. Giá trị của m là
A. 13,77.
B. 13,65.
C. 13,23.
D. 13,25.
-
Câu 32:
Mô hình thí nghiệm dùng để điều chế chất khí Z:
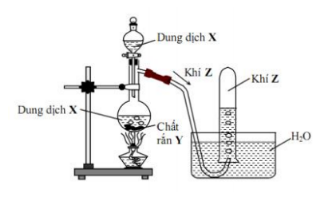
Phương trình hóa học nào sau đây phù hợp với mô hình trên?
A. CaC2 + 2H2O → Ca(OH)2 + C2H2.
B. Al4C3 + 12HCl → 4AlCl3 + 3CH4.
C. H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O.
D. CH3COONa + NaOH → CH4 + Na2CO3.
-
Câu 33:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau
Mẫu thử Thuốc thử Hiện tượng X Dung dịch I2 Màu xanh tím Y Cu(OH)2/OH- Có màu tím Z AgNO3/NH3 Kết tủa Ag trắng sáng T Dung dịch NaOH Tạo chất không tan Dung dịch X, Y, Z, T lần lượt là
A. Hồ tinh bột, lòng trắng trứng, phenyl amoni clorua, fructozơ.
B. Lòng trắng trứng, phenyl amoni clorua, hồ tinh bột, fructozơ.
C. Hồ tinh bột, lòng trắng trứng, fructozơ, phenyl amoni clorua.
D. Hồ tinh bột, fructozơ, lòng trắng trứng, phenyl amoni clorua.
-
Câu 34:
Cho m gam hỗn hợp Al và BaO vào H2O thu được dung dịch X và V lít khí H2 (đktc). Khi nhỏ từ từ dung dịch HCl vào dung dịch X, kết quả thí nghiệm được biểu diễn trên đồ thị sau
.png)
Giá trị của m là:
A. 61,2.
B. 38,25.
C. 38,7.
D. 45,9.
-
Câu 35:
Đốt cháy hoàn toàn m gam anđehit đơn chức, mạch hở X (phân tử chứa không qu| 4 nguyên tử C), thu được 6,72 lít CO2 (đktc) và 1,8 gam H2O. Mặt khác, khi cho 1,35 gam X tác dụng tối đa với a mol AgNO3/NH3. Giá trị của a là
A. 0,025.
B. 0,05.
C. 0,075.
D. 0,1.
-
Câu 36:
Có các nhận xét sau:
(a) Nhúng thanh Fe vào dung dịch FeCl3 xảy ra ăn mòn điện hóa.
(b) Sục khí H2S vào dung dịch CuSO4 thấy xuất hiện kết tủa xanh nhạt.
(c) Nhỏ dung dịch Na2CO3 vào dung dịch FeCl3 thấy xuất hiện kết tủa nâu đỏ và khí.
(d) Nhúng thanh Al vào dung dịch NaOH loãng nguội thấy thanh Al tan dần.
(e) Đốt dây sắt trong khí Cl2 thấy tạo thành muối Fe (II) bám trên dây sắt.
Số nhận xét đúng làA. 1
B. 2
C. 3
D. 4
-
Câu 37:
Hỗn hợp X gồm metyl acrylat, vinyl axetat, buta-1,3-đien và vinyl axetilen. Để đốt cháy hoàn toàn 0,5 mol hỗn hợp X cần dùng 54,88 lít O2 (đktc) thu được CO2 và 23,4 gam H2O. Phần trăm khối lượng vinyl axetilen có trong X là
A. 30,50%.
B. 31,52%.
C. 21,55%.
D. 33,35%.
-
Câu 38:
Điện phân 200 ml dung dịch hỗn hợp MgCl2 1M và NaCl 1M với cường độ 2,68A trong 3 giờ (điện cực trơ, màng ngăn xốp). Sau khi kết thúc điện phân thấy dung dịch giảm m gam so với ban đầu. Giá trị của m là
A. 10,65.
B. 14,25.
C. 19,65.
D. 22,45.
-
Câu 39:
Hỗn hợp X gồm alanin và đipeptit (Gly-Val). Cho m gam X vào 100 ml dung dịch hỗn hợp H2SO4 0,25M và HCl 0,25M, thu được dung dịch Y. Cho toàn bộ Y phản ứng vừa đủ với 240 ml dung dịch gồm NaOH 0,3M và KOH 0,2M đun nóng, thu được 10,9155 gam muối trung hòa. Phần trăm khối lượng của alanin trong X là
A. 43,88%.
B. 56,12%.
C. 16,98%.
D. 76,72%.
-
Câu 40:
Hòa tan hoàn toàn 8,976 gam hỗn hợp X gồm FeS2, FeS, Cu2S và Cu trong 864 ml dung dịch HNO3 1M đun nóng, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,186 mol một chất khí thoát ra. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 11,184 gam kết tủa. Mặt khác, dung dịch Y phản ứng tối đa với m gam Fe, biết trong các quy trình trên, sản phẩm khử duy nhất của NO3- là NO. Giá trị của m là
A. 16,464.
B. 8,4.
C. 17,304.
D. 12,936.














