Trắc nghiệm Hoá thí nghiệm Hóa Học Lớp 12
-
Câu 1:
Thực hiện các thí nghiệm sau:
(1) Cho hỗn hợp gồm 2a mol Na và a mol Al vào lượng nước dư.
(2) Cho a mol bột Cu vào dung dịch chứa a mol Fe2(SO4)3.
(3) Cho dung dịch chứa a mol KHSO4 vào dung dịch chứa a mol KHCO3.
(4) Cho dung dịch chứa a mol BaCl2 vào dung dịch chứa a mol CuSO4.
(5) Cho dung dịch chứa a mol Fe(NO3)2 vào dung dịch chứa a mol AgNO3.
(6) Cho a mol Na2O vào dung dịch chứa a mol CuSO4.
Số trường hợp thu được dung dịch chứa hai muối là
A. 2
B. 3
C. 4
D. 1
-
Câu 2:
Cho các thí nghiệm sau:
(a) Cho a mol bột Fe vào dung dịch chứa a mol AgNO3 và a mol Fe(NO3)3.
(b) Cho dung dịch chứa a mol K2Cr2O7 vào dung dịch chứa a mol NaOH.
(c) Cho dung dịch chứa a mol NaHSO4 vào dung dịch chứa a mol BaCl2.
(d) Cho dung dịch chứa a mol KOH vào dung dịch chứa a mol NaH2PO4.
(e) Cho a mol khí CO2 vào dung dịch chứa 1,5a mol KOH.
(f) Cho dung dịch chứa a mol HCl vào dung dịch chứa 2a mol KAlO2.
(g) Cho a mol Fe(OH)2 vào dung dịch chứa a mol H2SO4 loãng.
(h) Cho a mol Na2O vào dung dịch chứa a mol BaCl2 và a mol NaHCO3.
Số thí nghiệm thu được dung dịch chứa hai chất tan sau khi các phản ứng xảy ra hoàn toàn là
A. 5
B. 6
C. 7
D. 4
-
Câu 3:
Thí nghiệm nào sau đây sau khi kết thúc phản ứng, thu được natri hiđroxit?
A. Cho dung dịch chứa 2a mol NaHCO3 vào dung dịch chứa a mol Ca(OH)2
B. Cho dung dịch chứa a mol NaHCO3 vào dung dịch chứa a mol Ca(OH)2
C. Cho Na2O vào dung dịch CuSO4 dư
D. Điện phân dung dịch NaCl bằng điện cực trơ, không màng ngăn xốp
-
Câu 4:
Etilen có lẫn các tạp chất SO2, CO2, hơi nước. Có thể loại bỏ tạp chất bằng cách nào dưới đây?
A. Dẫn hỗn hợp đi qua bình đựng dung dịch brom dư.
B. Dẫn hỗn hợp qua bình đựng dung dịch Natri clorua dư.
C. Dẫn hỗn hợp lần lượt qua bình đựng dung dịch NaOH dư và bình đựng CaO.
D. Dẫn hỗn hợp lần lượt qua bình đựng dung dịch brom dư và bình đựng dung dịch H2SO4 đặc.
-
Câu 5:
Thí nghiệm nào sau đây dùng điều chế axetilen trong phòng thí nghiệm?
A. Cho nước vào ống nghiệm có chứa đất đèn.
B. Cho nhôm cacbua vào nước.
C. Đun nóng ancol etylic với H2SO4 đặc ở nhiệt độ cao.
D. Nhiệt phân khí metan.
-
Câu 6:
Cho sơ đồ điều chế và thử tính chất của chất X như hình vẽ
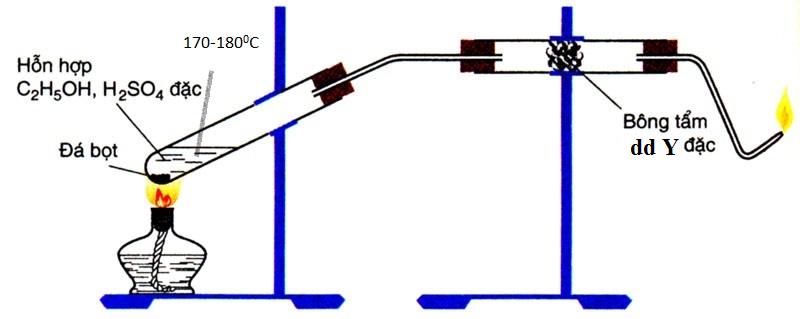
X và Y lần lượt là
A. CH4 và NaOH đặc
B. C2H4 và NaOH đặc
C. CH4 và H2SO4 đặc
D. C2H4 và H2SO4 đặc
-
Câu 7:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3−,SO42−,PO43−,CO32−,ClO4−,…NO3−,SO42−,PO43−,CO32−,ClO4−,…).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O→O2+4H++4e2H2O→O2+4H++4e
+ Thứ tự anion bị điện phân: S2−>I−>Br−>Cl−>RCOO−>OH−>H2OS2−>I−>Br−>Cl−>RCOO−>OH−>H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O+2e→H2+2OH−2H2O+2e→H2+2OH−
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4,Fe2(SO4)3,HNO3,Al(NO3)3CuSO4,Fe2(SO4)3,HNO3,Al(NO3)3 Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2 với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC)
Trong thí nghiệm 2, giá trị của m là:
A. 7,24g
B. 3,12g
C. 6,5g
D. 6,24g
-
Câu 8:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3−,SO42−,PO43−,CO32−,ClO4−,…NO3−,SO42−,PO43−,CO32−,ClO4−,…).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O→O2+4H++4e2H2O→O2+4H++4e
+ Thứ tự anion bị điện phân: S2−>I−>Br−>Cl−>RCOO−>OH−>H2OS2−>I−>Br−>Cl−>RCOO−>OH−>H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O+2e→H2+2OH−2H2O+2e→H2+2OH−
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4,Fe2(SO4)3,HNO3,Al(NO3)3CuSO4,Fe2(SO4)3,HNO3,Al(NO3)3 Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2 với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC)
Trong thí nghiệm 1, kim loại bám vào catot sau khi dừng điện phân là
A. Cu, Fe
B. Cu, Fe, Al.
C. Cu
D. Fe, Al
-
Câu 9:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3−,SO42−,PO43−,CO32−,ClO4−,…NO3−,SO42−,PO43−,CO32−,ClO4−,…).
Khi đó nước bị điện phân theo bán phản ứng: 2H2O→O2+4H++4e2H2O→O2+4H++4e
+ Thứ tự anion bị điện phân: S2−>I−>Br−>Cl−>RCOO−>OH−>H2OS2−>I−>Br−>Cl−>RCOO−>OH−>H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…
Khi đó nước bị điện phân theo bán phản ứng: 2H2O+2e→H2+2OH−2H2O+2e→H2+2OH−
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời CuSO4,Fe2(SO4)3,HNO3,Al(NO3)3CuSO4,Fe2(SO4)3,HNO3,Al(NO3)3 Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì cho đến khi bắt đầu thấy xuất hiện khí ở catot thì dừng điện phân.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2 với điện cực trơ, cường độ dòng điện 5A, trong 32 phút 10 giây. Sau khi dừng điện phân, sinh viên đó nhấc catot và đem rửa sach, sấy khô và đem cân thấy khối lượng catot tăng m gam so với ban đầu. Biết hiệu suất điện phân đạt 100%. (Cho NTK: Cu = 64 đvC; Ag = 108 đvC)
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
A. 2SO42−→2SO3+O2+4e2SO42−→2SO3+O2+4e
B. 2H2O→O2+4H++4e2H2O→O2+4H++4e
C. 2H2O+2e→2OH−+H2.2H2O+2e→2OH−+H2.
D. 4NO3−→2N2O5+O2+4e.4NO3−→2N2O5+O2+4e.
-
Câu 10:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3−,SO42−,PO43−,CO32−,ClO4−,…NO3−,SO42−,PO43−,CO32−,ClO4−,…). Khi đó nước bị điện phân theo bán phản ứng:2H2O→O2+4H++4e2H2O→O2+4H++4e
+ Thứ tự anion bị điện phân: S2−>I−>Br−>Cl−>RCOO−>OH−>H2OS2−>I−>Br−>Cl−>RCOO−>OH−>H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…. Khi đó nước bị điện phân theo bán phản ứng: 2H2O+2e→H2+2OH−2H2O+2e→H2+2OH−
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3,Cu(NO3)2,Fe(NO3)3,Mg(NO3)2AgNO3,Cu(NO3)2,Fe(NO3)3,Mg(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Trong thí nghiệm 2, giá trị của t là:
A. 2520,5
B. 1440
C. 1800
D. 1440,5
-
Câu 11:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3−,SO42−,PO43−,CO32−,ClO4−,…NO3−,SO42−,PO43−,CO32−,ClO4−,…). Khi đó nước bị điện phân theo bán phản ứng:2H2O→O2+4H++4e2H2O→O2+4H++4e
+ Thứ tự anion bị điện phân: S2−>I−>Br−>Cl−>RCOO−>OH−>H2OS2−>I−>Br−>Cl−>RCOO−>OH−>H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…. Khi đó nước bị điện phân theo bán phản ứng: 2H2O+2e→H2+2OH−2H2O+2e→H2+2OH−
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3,Cu(NO3)2,Fe(NO3)3,Mg(NO3)2AgNO3,Cu(NO3)2,Fe(NO3)3,Mg(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Trong thí nghiệm 1, thứ tự kim loại sinh ra tại catot?
A. Ag, Fe, Cu
B. Ag, Cu, Fe, Mg.
C. Fe, Cu, Ag
D. Ag, Cu, Fe
-
Câu 12:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3−,SO42−,PO43−,CO32−,ClO4−,…NO3−,SO42−,PO43−,CO32−,ClO4−,…). Khi đó nước bị điện phân theo bán phản ứng:2H2O→O2+4H++4e2H2O→O2+4H++4e
+ Thứ tự anion bị điện phân: S2−>I−>Br−>Cl−>RCOO−>OH−>H2OS2−>I−>Br−>Cl−>RCOO−>OH−>H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…K+,Na+,Ca2+,Ba2+,Mg2+,Al3+…. Khi đó nước bị điện phân theo bán phản ứng: 2H2O+2e→H2+2OH−2H2O+2e→H2+2OH−
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3,Cu(NO3)2,Fe(NO3)3,Mg(NO3)2AgNO3,Cu(NO3)2,Fe(NO3)3,Mg(NO3)2bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở anot?
A. Ag++1e→AgAg++1e→Ag
B. 2H2O+2e→2OH−+H22H2O+2e→2OH−+H2
C. 2H2O→O2+4H++4e2H2O→O2+4H++4e
D. 4NO3−→2N2O5+O2+4e.4NO3−→2N2O5+O2+4e.
-
Câu 13:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
.png)
Sau một thời gian, sinh viên quan sát thấy có 3,84 gam kim loại đồng bám lên điệc cực của bình 1. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Trong thí nghiệm 2, số gam kim loại Ag bám lên điện cực trong bình 2 là:
A. 0 gam
B. 3,24 gam
C. 12,96 gam
D. 6,48 gam
-
Câu 14:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
.png)
Sau một thời gian, sinh viên quan sát thấy có 3,84 gam kim loại đồng bám lên điệc cực của bình 1. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Nếu trong thí nghiệm 1, người sinh viên đối 2 điện cực than chì bằng 2 điện cực kim loại Pb, phản ứng nào xảy ra ở catot và anot?
A. Catot:Pb2++2e→Pb;Anot:2H2O→O2+4H++4e.Catot:Pb2++2e→Pb;Anot:2H2O→O2+4H++4e.
B. Catot:Al3++3e→Al;Anot:Pb→Pb2++2e.Catot:Al3++3e→Al;Anot:Pb→Pb2++2e.
C. Catot:2H2O+2e→H2+2OH−;Anot:Pb→Pb2++2e.Catot:2H2O+2e→H2+2OH−;Anot:Pb→Pb2++2e.
D. Catot:Pb2++2e→Pb;Anot:Pb→Pb2++2eCatot:Pb2++2e→Pb;Anot:Pb→Pb2++2e
-
Câu 15:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân:
+ Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
Cho dãy điện hóa sau:
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời Pb(NO3)2 và Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên.
.png)
Sau một thời gian, sinh viên quan sát thấy có 3,84 gam kim loại đồng bám lên điệc cực của bình 1. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Ag, Cu và Al lần lượt là 108; 64 và 27 đvC.
Trong thí nghiệm 1, bán phản ứng nào xảy ra ở carot?
A. Pb2++2e→Pb.Pb2++2e→Pb.
B. Al3++3e→Al.Al3++3e→Al.
C. O2+4H++4e→2H2O.O2+4H++4e→2H2O.
D. H2O+2e→H2+2OH−.H2O+2e→H2+2OH−.
-
Câu 16:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
+ Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan).
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2 bằng hệ điện phân sử dụng điện cực Cu.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2 và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5.
Từ thí nghiệm 2, khối lượng dung dịch giảm là:
A. 13,5 gam
B. 6,4 gam
C. 7,1 gam
D. 6,75 gam
-
Câu 17:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
+ Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan).
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2 bằng hệ điện phân sử dụng điện cực Cu.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2 và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5.
Nếu trong thí nghiệm 1, sinh viên thay điện cục Cu bằng điện cực than chỉ thì bán phản ứng ở anot là
A. Cu→Cu2++2e.Cu→Cu2++2e.
B. 2Cl−→Cl2+2e.2Cl−→Cl2+2e.
C. 2H2O→O2+4H++4e.2H2O→O2+4H++4e.
D. Cu2++2e→Cu.Cu2++2e→Cu.
-
Câu 18:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
+ Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan).
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2 bằng hệ điện phân sử dụng điện cực Cu.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2 và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5.
Từ thí nghiệm 1, cho biết bán phản ứng nào xảy ra ở anot
A. Cu→Cu2++2e.Cu→Cu2++2e.
B. 2Cl−→Cl2+2e.2Cl−→Cl2+2e.
C. 2H2O→O2+4H++4e.2H2O→O2+4H++4e.
D. Cu2++2e→Cu.Cu2++2e→Cu.
-
Câu 19:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Trong thí nghiệm 2, thể tích khí thoát ra tại điện cực anot là
A. 0,224 lít.
B. 2,24 lít.
C. 0,448 lít.
D. 4,48 lít.
-
Câu 20:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Trong thí nghiệm 1, giá trị pH của dung dịch thay đổi như thế nào?
A. pH tăng do OH- sinh ra ở catot.
B. pH giảm do H+ sinh ra ở anot.
C. pH không đổi do không có H+ và OH- sinh ra.
D. pH không đổi do lượng H+ sinh ra ở anot bằng với lượng OH- sinh ra ở catot
-
Câu 21:
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch:
*Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O
* Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
.png)
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Fe(NO3)3, Cu(NO3)2, Fe(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuCl2. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết nguyên tử khối của Cu và Cl lần lượt là 64 và 35,5.
Trong thí nghiệm 1, thứ tự điện phân các cation tại carot là:
A. Ag+,Cu2+,Fe3+,Fe2+.Ag+,Cu2+,Fe3+,Fe2+.
B. Ag+,Fe3+,Cu2+,Fe2+.Ag+,Fe3+,Cu2+,Fe2+.
C. Ag+,Fe2+,Cu2+,Fe3+.Ag+,Fe2+,Cu2+,Fe3+.
D. Fe3+,Ag+,Cu2+,Fe2+.Fe3+,Ag+,Cu2+,Fe2+.
-
Câu 22:
Thực hiện các thí nghiệm sau:
(1) Nung hỗn hợp Fe và KNO3 trong khí trơ
(2) Cho luồng khí H2 đi qua bột CuO nung nóng.
(3) Đốt dây Mg trong bình kín chứa đầy SO2.
(4) Nhúng dây Ag vào dung dịch HNO3
Số thí nghiệm xảy ra phản ứng oxi hóa kim loại:
A. 1
B. 4
C. 2
D. 3
-
Câu 23:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Sục khí H2S vào dung dịch FeCl3
(c) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2
(d) Cho K dư vào dung dịch Ca(H2PO4)2
(e) Cho dung dịch (NH4)2CO3 vào dung dịch Ba(OH)2
Số thí nghiệm thu được kết tủa là
A. 3
B. 2
C. 5
D. 4
-
Câu 24:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư
(b) Sục khí Cl2 vào dung dịch FeCl2
(c) Dẫn khí H2 dư qua bột CuO nung nóng
(d) Cho Na vào dung dịch CuSO4 dư
(e) Nhiệt phân AgNO3
(f) Điện phân nóng chảy Al2O3
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
A. 4
B. 2
C. 3
D. 5
-
Câu 25:
Tiến hành các thí nghiệm:
(a) Cho bạc kim loại vào dung dịch sắt (III) nitrat.
(b) Cho dung dịch bạc nitrat vào dung dịch sắt (III) nitrat.
(c) Cho sắt kim loại vào dung dịch sắt (III) clorua.
(d) Cho dung dịch bạc nitrat vào dung dịch sắt (II) nitrat.
(e) Cho đồng kim loại vào dung dịch sắt (III) nitrat
Các thí nghiệm xảy ra phản ứng là
A. 2
B. 3
C. 4
D. 5
-
Câu 26:
Tiến hành các thí nghiệm sau:
1) Cho lá Fe vào dung dịch gồm CuSO4 và H2SO4 loãng
2) Đốt dây Fe trong bình đựng khí O2;
3) Cho lá Cu vào dung dịch gồm Fe(NO3)3 và HNO3;
4) Cho lá Zn vào dung dịch HCl;
Số thí nghiệm có xảy ra ăn mòn điện hóa là
A. 2
B. 1
C. 3
D. 4
-
Câu 27:
Phản ứng điều chế NaOH trong công nghiệp là:
A. 2Na+2H2O→2NaOH+H2
B. 2NaCl+2H2O→2NaOH+Cl2+H2
C. Na2O+H2O→2NaOH
D. Na2SO4+Ba(OH)2→2NaOH+BaSO4
-
Câu 28:
Tiến hành các thí nghiệm sau:
(a) Sục khí axetilen vào dung dịch KMnO4 loãng.
(b) Cho hơi ancol etylic đi qua bột CuO nung nóng.
(c) Sục khí etilen vào dung dịch Br2 trong CCl4.
(d) Cho Buta-1,3- đien vào dung dịch AgNO3, trong NH3 dư, đun nóng.
(e) Cho Li vào ancol etylic.
Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng là
A. 2
B. 4
C. 5
D. 3
-
Câu 29:
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng
(a) bông khô
(b) bông có tẩm nước
(c) bông có tẩm nước vôi trong
(d) bông có tẩm giấm ăn
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
A. b
B. a
C. d
D. c
-
Câu 30:
Dùng cách nào để rửa sạch lọ đựng anilin?
A. Rửa bằng nước sau đó tráng bằng dung dịch kiềm.
B. Rửa bằng dung dịch axit sau đó tráng bằng nước.
C. Rửa bằng dung dịch kiềm sau đó tráng bằng nước.
D. Rửa bằng nước sau đó tráng bằng dung dịch axit.
-
Câu 31:
Hóa chất dùng để tách phenol ra khỏi hỗn hợp phenol, anilin, benzen là gì?
A. NaOH, HCl.
B. H2O, CO2.
C. Br2, HCl.
D. HCl, NaOH.
-
Câu 32:
Phát biểu nào đúng biết ba chất hữu Cơ mạch hở X, Y, Z có cùng công thức phùn tử C2H4O2 có các tính chất sau:
- X tác dụng với Na2CO giải phóng CO2.
- Y tác dụng với Na và tham gia tráng bạc.
- Z tác dụng với dung dịch NaOH nhưng không tác dụng với Na.
A. Z không tham gia tráng bạc.
B. Z có nhiệt độ sổi cao hơn X.
C. Y là hợp chất hữu cơ đơn chức.
D. Hiđro hoá Y thu được ctylen glicol.
-
Câu 33:
Hai chất nào sau đây đều tan tốt trong nước là gì?
A. CH3COOH và CH3NH2
B. CH3COOCH3 và CH3OH
C. HCOOH và Tinh bột
D. C6H5NH2 và CH3COOH
-
Câu 34:
PUHH không tạo ra dung dịch có màu là?
A. Glixerol với Cu(OH)2
B. Dung dịch axit axetic với Cu(OH)2
C. Dung dịch lòng trắng trứng với Cu(OH)2
D. Glyxin với dung dịch NaOH
-
Câu 35:
Xác định X biết chất X được điều chế bằng sơ đồ
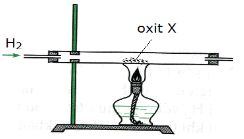
A. Al2O3.
B. K2O.
C. CuO.
D. MgO.
-
Câu 36:
Một mẫu khí thải sục vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện tượng này do trong khí thải có ?
A. NO2.
B. H2S.
C. CO2.
D. SO2.
-
Câu 37:
Cho khí X đi qua hơi nước thấy có hiện tượng bốc cháy. Khí X có thể là ?
A. Br2
B. F2
C. I2
D. Cl2
-
Câu 38:
Người ta thu khí X sau khi điều chế như hình vẽ bên dưới.
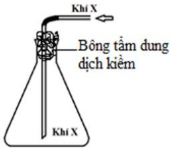
Trong các khí: N2, Cl2, SO2, NO2, số chất thoả mãn điều kiện bài toán?
A. 4
B. 1
C. 3
D. 2
-
Câu 39:
TN nào sau đây có phản ứng hóa học xảy ra?
A. Cho dung dịch Fe(NO3)3 vào dung dịch AgNO3
B. Cho Cr2O3 vào dung dịch NaOH loãng.
C. Nhỏ dung dịch Br2 vào dung dịch chứa NaCrO2 và NaOH.
D. Cho bột Fe vào dung dịch HNO3 đặc, nguội.
-
Câu 40:
Ở PTN, khí X được điều chế và thu vào bình tam giác theo hình vẽ bên.
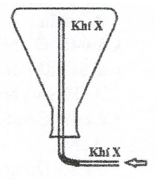
Khí X được tạo ra từ phản ứng hóa học nào sau đây?
A. 2Fe + 6H2SO4 (đặc) → Fe2(SO4)3 + 3SO2(k) + 6H2O
B. NH4Cl + NaOH → NH3(k) + NaCl + H2O
C. CaCO3 + 2HCl → CaCl2 + CO2(k) + H2O
D. 3Cu + 8HNO3 (loãng) → 3Cu(NO3)2 + 2NO(k) + 4H2O
-
Câu 41:
Kim loại nào sau đây không tan trong dung dịch HCl nhưng tan trong dung dịch HCl có sục khí O2 dư?
A. Cu
B. Fe
C. Al
D. Au
-
Câu 42:
Hình vẽ sau đây mô tả thí nghiệm điều chế chất lỏng Y từ dung dịch X:
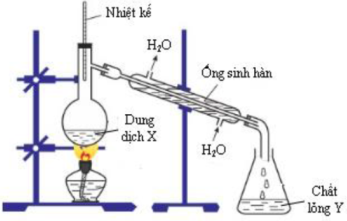
Trong thí nghiệm, xẩy ra phản ứng hóa học nào sau đây?
A. H2N-CH2-COOH + NaOH → H2N-CH2-COONa + H2O.
B. CH3COOH + C6H5OH → CH3COOC6H5 + H2O.
C. CH3COOH + C2H5OH → CH3COOC2H5 + H2O.
D. CH3NH3Cl + NaOH → NaCl + CH3NH2 + H2O.
-
Câu 43:
Ba dung dịch X,Y,Z, thỏa mãn
- X tác dụng với Y thì có tủa xuất hiện
- Ytác dụng với Z thì có tủa xuất hiện
- X tác dụng với Z thì có khí thoát ra .
X, Y, Z, lần lượt là
A. Al2(SO4)3, BaCl2, Na2SO4
B. FeCl2, Ba(OH)2, AgNO3
C. NaHSO4, BaCl2, Na2CO3
D. NaHCO3, NaHSO4, BaCl2
-
Câu 44:
Tiến hành các thí nghiệm sau:
(a) Cho Al vào dung dịch FeCl3 dư.
(b) Cho dung dịch AgNO3 dư vào dung dịch FeCl2.
(c) Nhiệt phân Cu(NO3)2.
(d) Đốt nóng FeCO3 trong không khí.
(e) Điện phân dung dịch AgNO3 với điện cực trơ.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
A. 2
B. 3
C. 4
D. 5
-
Câu 45:
Quan sát sơ đồ thí nghiệm:
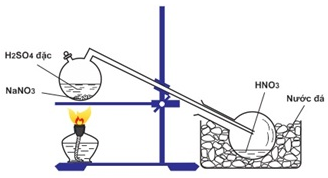
Phát biểu nào sau đây là không đúng về quá trình điều chế HNO3 trong phòng thí nghiệm theo sơ đồ trên?
A. Bản chất của quá trình điều chế là một phản ứng trao đổi ion
B. HNO3 sinh ra trong bình cầu ở dạng hơi nên cần làm lạnh để ngưng tụ
C. Quá trình phản ứng là một quá trình thuận nghịch, trong đó chiều thuận là chiều toả nhiệt
D. Do HNO3 có phân tử khối lớn hơn không khí nên mới thiết kế ống dẫn hướng xuống
-
Câu 46:
Cho hình vẽ mô tả thí nghiệm điều chế khí Y từ dung dịch X:
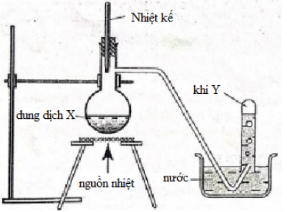
Hình vẽ trên minh họa cho phản ứng nào dưới đây:
A. C2H5OH → C2H4 + H2O
B. NH4Cl + NaOH → NaCl + NH3 + H2O
C. CH3COONa + HCl → CH3COOH + NaCl
D. C2H5NH3Cl + NaOH → C2H5NH2 + NaCl + H2O
-
Câu 47:
Chỉ dùng một thuốc thử phân biệt các kim loại sau: Mg, Zn, Fe, Ba?
A. Nước.
B. Dung dịch H2SO4 loãng.
C. Dung dịch NaCl.
D. Dung dịch NaOH.
-
Câu 48:
Phát biểu sai là gì?
A. Na2CO3 dùng để tẩy sạch vết dầu mỡ bám trên chi tiết máy trước khi sơn.
B. Có thể dùng thùng làm bằng sắt để chuyên chở H2SO4 và HNO3 đặc nguội.
C. Be được dùng làm chất phụ gia để chế tạo hợp kim có tính đàn hồi, bền, chắt không bị ăn mòn.
D. Thổi khí NH3 qua CrO3 đun nóng thấy chất rắn chuyển từ màu đỏ sang màu đen.
-
Câu 49:
Hình vẽ mô tả thí nghiệm điều chế chất hữu cơ Y:
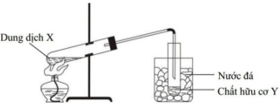
Phản ứng nào sau đây xảy ra trong thí nghiệm trên là gì?
A. 2C6H12O6 + Cu(OH)2 → (C6H11O6)2Cu + H2O
B. CH3COOH + C2H5OH ⇆ CH3COOC2H5 + H2O
C. H2NCH2COOH + NaOH → H2NCH2COONa + H2O
D. CH3COOH + NaOH → CH3COONa + H2O
-
Câu 50:
A gồm một axit đa chức X và một hợp chất hữu cơ tạp chức Y đều có thành phần chứa các nguyên tử C, H, O. Tiến hành 3 TN với m gam hỗn hợp A
- TN1: phản ứng hoàn toàn với lượng dư AgNO3 trong NH3 thu được 43,2 gam Ag.
- TN2: phản ứng vừa đủ với 100 ml dung dịch KHCO3 2M.
- TN3: phản ứng vừa đủ với 100 ml dung dịch KOH 4M, thu được 1 ancol duy nhất Z và hỗn hợp T gồm hai muối. Dẫn toàn bộ Z qua bình đựng Na dư thấy khối lượng bình tăng 9 gam, đồng thời thu được 2,24 lít khí H2. Đốt cháy hoàn toàn hỗn hợp T bằng lượng O2 vừa đủ thu được 8,96 lít CO2, nước và muối cacbonat.
Tính phần trăm khối lượng của Y trong hỗn hợp A có giá trị gần nhất với giá trị
A. 69,5%.
B. 31,0%.
C. 69,0%.
D. 30,5%.














