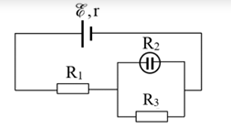
ho mạch điện như hình vẽ: Nguồn điện có suất điện động E = 12V, điện trở trong \(r = 1 \Omega, R_2 = 12 \Omega\) và là bình điện phân đựng dung dịch AgNO3 với điện cực anôt bằng bạc, \(R_1 = 3\Omega, R_3 = 6\Omega\). Cho biết bạc (Ag) có khối lượng mol là 108g/mol, hóa trị 1, hằng số Faraday F = 96500C/mol. Khối lượng bạc bám vào catot sau thời gian 16 phút 5 giây là
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo saiCấu tạo mạch: \((R_2//R_3)ntR_1\)
Ta có: \(\begin{array}{l} {R_{23}} = \frac{{{R_2}{R_3}}}{{{R_2} + {R_3}}} = \frac{{12.6}}{{12 + 6}} = 4\Omega \\ \to {R_N} = {R_1} + {R_{23}} = 3 + 4 = 7\Omega \end{array}\)
Áp dụng định luật Ôm cho toàn mạch, ta có:
\( I = \frac{E}{{{R_N} + r}} = \frac{{12}}{{7 + 1}} = 1,5A = {I_1} = {I_{23}}\)
Ta có: \(U_{23}=I_{23}.R_{23}=1,5.4=6(V)=U_2=U_3\)
\( \to {I_2} = \frac{{{U_2}}}{{{R_2}}} = \frac{6}{{12}} = 0,5A\)
Khối lượng bạc bám vào catot là:
\( {m_{Ag}} = \frac{1}{F}\frac{A}{n}{I_2}t = \frac{1}{{96500}}.\frac{{108}}{1}.0,5(16.60 + 5) = 0,54g\)