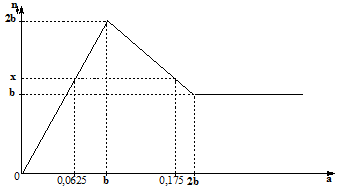
Cho từ từ dung dịch chứa a mol Ba(OH)2 vào dung dịch chứa b mol ZnSO4. Đồ thì biểu diễn số mol kết tủa theo giá trị của a như sau:
Giá trị của b là:
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo saiTại \(n_{Ba(OH)_{2}}\) = 2b mol thì kết tủa ổn định ⇒ chỉ có BaSO4 (x > b > 0,0625)
Tại \(n_{Ba(OH)_{2}}\) = 0,0625 và 0,175 mol thì đều có lượng kết tủa x như nhau
+) Tại: \(n_{Ba(OH)_{2}}\) = 0,0625 mol [SO42- dư và Zn2+ dư]
\(\Rightarrow n_{BaSO_{4}} = 0,0625 \ mol ; \ n_{Zn(OH)_{2}} = 0,0625 \ mol\)
+) Tại: \(n_{Ba(OH)_{2}}\) = 0,175 mol [Ba2+, có hòa tan kết tủa 1 phần]
\(\Rightarrow n_{BaSO_{4}} = b ; \ n_{Zn(OH)_{2}} = (2n_{Zn^{2+}} - \frac{1}{2} .n_{OH^-}) = (2b - \frac{1}{2}.0,175.2)\)
Số mol kết tủa là như nhau ở 2 thời điểm trên
\(\Rightarrow 0,0625 + 0,0625 = b + (2b -\frac{1}{2}.0,175.2)\)
⇒ b = 0,1 mol














