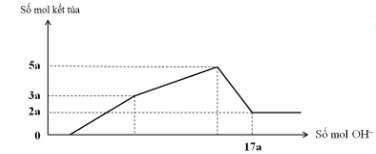
Cho hết 12,060 gam hỗn hợp gồm Mg và Al2O3 trong dung dịch chứa HCl 0,5M và H2SO4 0,1M. Sau khi kết thúc phản ứng thu được dung dịch X. Cho từ từ dung dịch NaOH 1,0M vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
Nếu cho từ từ V ml dung dịch NaOH 0,3M và Ba(OH)2 0,1M vào dung dịch X, thu được kết tủa lớn nhất. Lấy kết tủa nung trong không khí đến khối lượng không đổi, thu được m gam chất rắn khan. Giá trị của m là:
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo saiĐặt 5x và x là số mol của HCl và H2SO4
Dựa vào đồ thị ta thấy nMg(OH)2 = 2a mol và n ↓ max = 5a mol → nAl(OH)3 = 3a mol
Vậy ban đầu nMg = 2a mol; nAl2O3 = 1,5a mol → 24.2a + 102.1,5a = 12,06 gam
→ a = 0,06 mol
Dung dịch X chứa 0,12 mol Mg2+, 0,18 mol Al3+, 5x mol Cl-, x mol SO42- → nH+ = 7x - 0,78 mol
→ nOH- = 17.0,06 = 7x - 0,78 + 0,12.2+ 0,18.4 → x = 0,12 mol
Vậy dung dịch X chứa 0,12 mol Mg2+, 0,18 mol Al3+, 0,6 mol Cl-, 0,12 mol SO42-; 0,06 mol H+
Đặt nNaOH = 3y mol và nBa(OH)2 = y mol → nBa2+ = y mol; nOH- = 3y + 2y = 5y mol
Khi BaSO4 đạt cực đại tại y = 0,12 mol:
Khi đó nOH- = 0,6 mol < nH+ + 2.nMg2+ + 3.nAl3+ = 0,84 mol → Kết tủa hiđroxit chưa đạt cực đại
→ Khi nOH- = 0,84 mol thì các kết tủa đều cực đại, bao gồm 0,12 mol BaSO4, 0,12 mol Mg(OH)2; 0,18 mol Al(OH)3.
Khi nung thu được 0,12 mol BaSO4, 0,12 mol MgO; 0,09 mol Al2O3 → m = 41,94 gam.














