Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với cường độ dòng điện không đổi, điện cực trơ thấy thể tích khí thoát ra ở cả 2 điện cực (V lít, đktc) và thời gian điện phân (t giây) phụ thuộc nhau theo đồ thị hình bên.
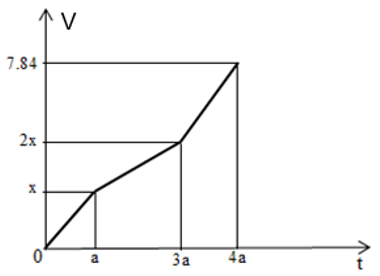
Nếu điện phân dung dịch đến thời gian 2a giây rồi dừng điện phân thì dung dịch sau điện phân có tổng số mol các chất tan là
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo sai- Chia đồ thị thành các đoạn như ở phần Phương pháp.
Ta thấy đoạn (2) độ dốc ít hơn so với đoạn (1)
Suy ra:
+ Giai đoạn 1: Khí Cl2 thoát ra từ anot (ở catot Cu2+ bị điện phân; ở anot Cl- bị điện phân)
+ Giai đoạn 2: Khí O2 thoát ra từ anot (ở catot Cu2+ bị điện phân; ở anot hết Cl-, nước bị điện phân)
+ Giai đoạn 3: Khí O2 thoát ra từ anot, khí H2 thoát ra từ catot (ở catot hết Cu2+, nước bị điện phân; ở anot nước bị điện phân).
- Khi kết thúc giai đoạn (1): t = a (s); ứng với sự trao đổi b (mol) electron
Ở anot: 2Cl- - 2e → Cl2 ↑
b → 0,5b (mol)
- Khi kết thúc giai đoạn (2): t = 3a (s); ứng với sự trao đổi 3b (mol) electron
Ở anot: 2Cl- - 2e → Cl2 ↑
b → 0,5b (mol)
H2O - 2e → 2H+ + ½ O2 ↑
2b → 0,5b (mol)
- Khi t = 4a (s), tổng số mol khí thu được là 0,35 mol; ứng với sự trao đổi 4b (mol) electron
Ở anot: 2Cl- - 2e → Cl2 ↑
b → 0,5b (mol)
H2O - 2e → 2H+ + ½ O2 ↑
3b → 0,75b (mol)
Ở catot: Cu2+ + 2e → Cu
3b → 1,5b (mol)
2H2O + 2e → 2OH- + H2 ↑
b → 0,5b (mol)
⟹ 0,5b + 0,75b + 0,5b = 0,35 ⟹ b = 0,2 mol
⟹ nCu(NO3)2 = 1,5.0,2 = 0,3 mol
nNaCl = b = 0,2 mol
- Khi t = 2a (s); ứng với sự trao đổi 2b = 0,4 mol electron
Ở anot: 2Cl- - 2e → Cl2 ↑
0,2 → 0,1 (mol)
H2O - 2e → 2H+ + ½ O2 ↑
0,2 → 0,05 (mol)
Ở catot: Cu2+ + 2e → Cu
0,4 → 0,2 (mol)
⟹ Dung dịch khi đó gồm
⟹ Tổng số mol các chất tan là 0,1 + 0,2 + 0,2 = 0,5 mol.
Đáp án B
Đề thi giữa HK2 môn Hóa học 12 năm 2021
Trường THPT Hoàng Văn Thụ



.png)











