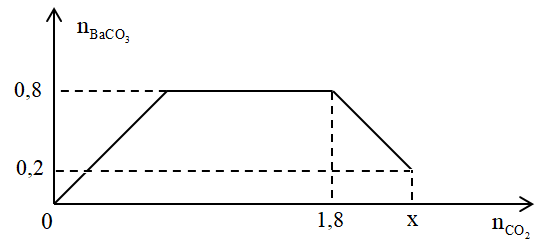
Cho từ từ x mol khí CO2 vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn theo biểu đồ sau:
Tổng nồng độ phần trăm khối lượng của các chất tan trong dung dịch sau phản ứng là
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo saiTại điểm A: nkết tủa = nBa2+ = nCO2 = 0,8 mol → nBa(OH)2 = 0,8 mol
Tại điểm B: kết tủa bắt đầu tan:
nCO3(2-) = nOH- - nCO2
⟹ 0,8 = nOH- - 1,8 → nOH- = 2,6 mol → nKOH = 2,6 - 0,8.2 = 1 mol
Tại điểm C: Kết tủa tan 1 phần:
nCO3(2-) = nOH- - nCO2
⟹ 0,2 = 2,6 - nCO2 → nCO2 = 2,4 mol
Dung dịch sau phản ứng có: 0,6 mol Ba2+; 1 mol K+; 2,2 mol HCO3- (áp dụng định luật bảo toàn điện tích)
⟹ mchất tan = 0,6.137 + 1.39 + 2,2.61 = 255,4 gam
Tương tự tìm mdd = mcác chất tham gia pứ - mkết tủa
= 2,4.44 + 500 - 0,2.197 = 566,2 (gam)
⟹ C%chất tan = \(\frac{255,4}{566,2}.100%\)= 45,11%
Đáp án A