Hòa tan 4,875 gam kim loại M (có hóa trị 2) trong HNO3 loãng, dư thì thu được 0,05 mol NO (sản phẩm khử duy nhất). Kim loại M là
Bộ Đề Thi Thử Tốt nghiệp THPT môn Hóa học năm 2025 - Đề thi thử Tốt nghiệp THPT môn Hóa học năm 2023
Đề thi thử Tốt nghiệp THPT môn Hóa học năm 2025 không chỉ giúp học sinh củng cố kiến thức đã học mà còn rèn luyện khả năng tư duy logic và giải quyết vấn đề nhanh chóng, chính xác. Đề thi bao gồm các dạng bài tập đa dạng để các em chuẩn bị tốt cho kỳ thi khác.
Câu hỏi liên quan
Nổ bụi là vụ nổ gây ra bởi quá trình bốc cháy nhanh của các hạt bụi mịn phân tán trong không khí bên trong một không gian hạn chế, tạo ra sóng nổ. Nổ bụi xảy ra khi có đủ năm yếu tố: nguồn oxygen, nguồn nhiệt, nhiên liệu (bụi có thể cháy được), nồng độ bụi mịn đủ lớn và không gian đủ kín. Năm 2007, một vụ nổ bụi xảy ra khi các công nhân hàn bảo trì bể chứa bột mì tại phân xưởng sản xuất bột mì ở tỉnh Bình Dương khiến 5 công nhân bị bỏng nặng.
Cho các phát biểu sau:
(a) Nổ bụi là một vụ nổ vật lí.
(b) Vụ nổ bụi xảy ra khi có đủ các yếu tố nguồn oxygen, nguồn nhiệt, không gian đủ kín.
(c) Nhiên liệu trong vụ nổ bụi tại phân xưởng bột mì ở Bình Dương là bụi bột mì.
(d) Bụi càng mịn khả năng gây nổ càng cao do phát tán nhanh và dễ lơ lửng trong không khí.
Số phát biểu sai là
Nồng độ ion \(\mathrm{NO}_{3}{ }^{-}\)trong nước uống tối đa cho phép là 9 ppm (part per million - phần triệu). Nếu thừa ion này sẽ gây ra một loại bệnh thiếu máu hoặc tạo thành nitrosamin (một hợp chất gây ung thư đường tiêu hóa). Để xác định hàm lượng ion \(\mathrm{NO}_{3}{ }^{-}\)trong 200 mL nước người ta dùng các hoá chất ( \(\mathrm{Cu}+\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng) thấy cần dùng đến \(1,92 \mathrm{mg} \mathrm{Cu}\). Hàm lượng \(\mathrm{NO}_{3}{ }^{-}\)trong mẫu nước trên là bao nhiêu?
Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. Câu 1. Nhúng thanh Cu tinh khiết có khối lượng là \(\mathrm{m}_{1}(\mathrm{gam})\) vào dung dịch iron(III) chloride, sau một thời gian, lấy thanh Cu ra cân lại thấy khối lượng là \(\mathrm{m}_{2}(\mathrm{gam})\). Cho các phát biểu sau:
Chromium có số oxi hóa là +3 trong hợp chất nào sau đây?
Để dập tắt các đám cháy do xăng dầu gây ra, người ta dùng cát hoặc bột chữa cháy \(\mathrm{MAP}\left(\mathrm{NH}_{4} \mathrm{H}_{2} \mathrm{PO}_{4}\right)\) mà không dùng nước. Cho các phát biểu sau:
(a) Xăng dầu nhẹ hơn nước và không tan trong nước nên nếu dùng nước xăng dầu sẽ nổi lên trên làm cho càng dễ cháy hơn.
(b) Cát hoặc bột chữa cháy MAP có tác dụng tạo lớp phủ bề mặt ngăn xăng dầu tiếp xúc với oxygen trong không khí.
(c) Quá trình nước bay hơi là quá trình tỏa nhiệt nên đám cháy xảy ra càng mạnh.
(d) Cát hoặc bột chữa cháy MAP hấp thụ nhiệt nên làm giảm nhiệt độ ngăn cản đám cháy.
Có bao nhiêu phát biểu sai?
Nối dung dịch sodium chloride với nguồn điện và một bóng đèn nhỏ. Quan sát thấy bóng đèn
Trong phòng thí nghiệm, có một mẫu dung dịch \(\mathrm{Sn}^{2+}\) có nồng độ \(\mathrm{x}(\mathrm{mol} / \mathrm{L})\). Để xác định nồng độ của dung dịch, người ta cho 100 mL dung dịch chứa ion trên tác dụng với dung dịch chứa \(\mathrm{Ce}^{4+} 0,1050 \mathrm{M}\) thì thấy cần dùng \(46,45 \mathrm{mL}\) dung dịch chứa \(\mathrm{Ce}^{4+}\) (đã thực hiện 3 lần và giá trị thể tích là trung bình). Hãy tính giá trị của 1000 x. (làm tròn đáp án đến hàng đơn vị). Biết rằng ion \(\mathrm{Ce}^{4+}\) có thể oxi hóa ion \(\mathrm{Sn}^{2+}\) lên \(\mathrm{Sn}^{4+}\) và nó bị khử xuống \(\mathrm{Ce}^{3+}\).
Để phòng bệnh bướu cổ và một số bệnh khác, mỗi người cần bổ sung \(1,5.10^{-4}\) gam iodine mỗi ngày. Biết rằng muối i-ốt chứa 25 gam KI trong 1 tấn muối ăn. Nếu nguồn cung cấp iodine là KI, thì khối lượng muối i-ốt mà mỗi người cần tiêu thụ mỗi ngày là
Các vụ hỏa hoạn ở các chung cư và nhà cao tầng hiện đang xảy ra liên tục với quy mô và mức độ tổn thất ngày càng cao. Các nạn nhân bị tử vong trong các vụ hỏa hoạn có thể do ngạt khí, bỏng nhiệt, nhảy từ trên cao xuống đất, bị vật nặng đè, giẫm đạp,... và số người chết thường không tập trung nhiều ở tâm đám cháy mà thường tập trung nhiều ở những nơi tích tụ khói hoặc có luồng khói đi qua. Khói từ đám cháy chứa các khí độc như carbon monoxide \((\mathrm{CO})\), hydrogen cyanide \((\mathrm{HCN})\) và các khí gây kích ứng khác.
Cho các phát biểu sau :
Đốt cháy hoàn toàn một mẩu dây sắt trong khí chlorine dư. Sau phản ứng thu được 42,12 gam chất rắn màu nâu đỏ. Khối lượng của mẩu dây sắt ban đầu là
Trước đây, tinh thể copper(II) sulfate được "nuôi" như sau:
Bước 1: Cho dung dịch sulfuric acid loãng vào cốc thuỷ tinh.
Bước 2: Đun nóng dung dịch acid.
Bước 3: Thêm copper (II) oxide vào đến dư.
Bước 4: Đợi phản ứng xảy ra hoàn toàn rồi lọc hỗn hợp thu được.
Bước 5: Làm bay hơi nước lọc cho đến khi tinh thể xuất hiện trong cốc.
Bước 6: Làm mát cốc nước lọc.
Cho các phát biểu sau:
Cho sơ đồ phản ứng sau (biết \(\mathrm{A}),(\mathrm{Z})\) là kim loại, muối \(\mathrm{C})\) có màu xanh, \(\mathrm{G})\) là phi kim):
(1) \(\mathrm{A})+(\mathrm{B}) \longrightarrow(\mathrm{C})+(\mathrm{D}) \uparrow+(\mathrm{E})\)
(2) \(\mathrm{D})+(\mathrm{E})+(\mathrm{G}) \longrightarrow(\mathrm{B})+(\mathrm{X})\)
(3) \(\mathrm{BaCl}_{2}+(\mathrm{C}) \longrightarrow(\mathrm{Y})+\mathrm{BaSO}_{4}\)
(4) \(\mathrm{Z})+(\mathrm{Y}) \longrightarrow(\mathrm{T})+(\mathrm{A})\)
(5) \(\mathrm{T})+(\mathrm{G}) \longrightarrow \mathrm{FeCl}_{3}\)
Tỉ lệ số nguyên tử trong \(\mathrm{D})\) và số nguyên tử trong \((\mathrm{Y})\) là
Potassium dichromate \(\left(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\right)\) có thể được sử dụng để phát hiện nồng độ còn trong hơi thở. Phương trình phản ứng của alcohol và \(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\) như sau:
\(3 \mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{OH}+2 \mathrm{Cr}_{2} \mathrm{O}_{7}{ }^{2-}+16 \mathrm{H}^{+} \longrightarrow 3 \mathrm{CH}_{3} \mathrm{COOH}+4 \mathrm{Cr}^{3+}+11 \mathrm{H}_{2} \mathrm{O}\)
Sau phản ứng, màu sắc chuyển từ cam sang xanh lục, dữ liệu đo được bằng thiết bị có thể chuyển đổi thành nồng độ cồn. Ở nhiệt độ và áp suất bình thường, tỷ lệ nồng độ cồn trong máu ( \(\mathrm{mg} / \mathrm{L}\) ) so với nồng độ cồn trong hơi thở \((\mathrm{mg} / \mathrm{L})\) hiện đang là 2100 : 1. Theo luật quy định, nồng độ cồn trong mỗi lít hơi thở không được vượt quá \(0,25 \mathrm{mg}\). Cho đồ thị thể hiện mối quan hệ giữa nồng độ cồn trong hơi thở và chỉ số đo bằng thiết bị như sau:
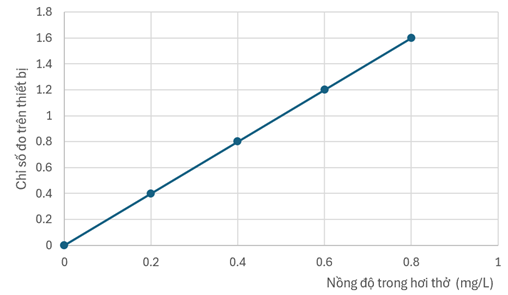
Khi chỉ số của thiết bị đo hơi thở của một người là 0,80 thì nồng độ cồn trong máu ( \(\mathrm{mmol} / \mathrm{L}\) ) của người đó là bao nhiêu? (làm tròn đáp án đến hàng đơn vị).
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Lấy vào ống nghiệm (1) \(0,5 \mathrm{mL}\) dung dịch \(\mathrm{HNO}_{3}\) đặc (68%)
ống nghiệm (2) \(0,5 \mathrm{mL}\) dung dịch HCl đặc.
Bước 2: Cho vào mỗi ống nghiệm một mảnh nhỏ đồng kim loại. Nút các ống nghiệm bằng bông tẩm dung dịch NaOH. Đun nhệ ống nghiệm thứ hai.
Cho các phát biểu sau:
(a) Ở ống nghiệm (1), mảnh đồng tan dần, dung dịch chuyển sang màu xanh.
(b) Ở ống nghiệm thứ hai, thấy có khí không màu, không hóa nâu thoát ra khỏi dung dịch.
(c) Bông tẩm dung dịch NaOH có tác dụng hạn chế khí độc thoát ra khỏi ống nghiệm.
(d) Có thể thay bông tẩm dung dịch NaOH bằng bông tẩm dung dịch NaCl.
Số phát biểu đúng là
Cho phản ứng hóa học: \(\mathrm{Zn}+\mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2} \longrightarrow \mathrm{Zn}\left(\mathrm{NO}_{3}\right)_{2}+\mathrm{Cu}\). Trong phản ứng trên xảy ra các quá trình là
Chất nào sau đây có thể oxi hóa Zn thành \(\mathrm{Zn}^{2+}\) ?
Cho các phản ứng sau:
(1) \(\mathrm{X}+2 \mathrm{X}^{3+} \longrightarrow 3 \mathrm{X}^{2+}\)
(2) \(\mathrm{X}^{2+}+\mathrm{Y}^{+} \longrightarrow \mathrm{X}^{3+}+\mathrm{Y}\)
Sự sắp xếp đúng với chiều tăng dần tính oxi hoá của các cation là
Cho thế điện cực chuẩn của các cặp oxi hóa - khử sau:\(\mathrm{E}_{\mathrm{MnO}_{4}^{-} / \mathrm{Mn}^{2+}}^{0}=+1,51 \mathrm{V}\) và \(\mathrm{E}_{\mathrm{Fe}^{3+} / \mathrm{Fe}^{2+}}^{0}=+0,77 \mathrm{V}\)
Phát biểu nào sau đây sai?
Cho phản ứng chuẩn độ muối Mohr \(\left(\mathrm{FeSO}_{4} \cdot\left(\mathrm{NH}_{4}\right)_{2} \mathrm{SO}_{4} \cdot 6 \mathrm{H}_{2} \mathrm{O}\right)\) trong môi trường acid:
\(\mathrm{Cr}_{2} \mathrm{O}_{7}{ }^{2-}+14 \mathrm{H}^{+}+6 \mathrm{Fe}^{2+} \rightarrow 2 \mathrm{Cr}^{3+}+6 \mathrm{Fe}^{3+}+7 \mathrm{H}_{2} \mathrm{O}\)
Cần bao nhiêu milimol potassium dichromate để oxi hóa \(24 \mathrm{cm}^{3}\) dung dịch muối Mohr \(0,5 \mathrm{M}\) trong môi trường acid (làm tròn kết quả đến chữ số hàng đơn vị)?
Theo QCVN 01-1:2018/BYT, hàm lượng manganese (Mn) tối đa cho phép trong nước sinh hoạt không được vượt quá \(0,3 \mathrm{mg} / \mathrm{L}\). Một mẫu nước chứa \(\mathrm{Mn}^{2+}\) với nồng độ chưa xác định. Để đánh giá hàm lượng manganese trong \(5 \mathrm{m}^{3}\) mẫu nước trên, người ta tiến hành tách loại manganese bằng cách sử dụng 50 gam \(\mathrm{KMnO}_{4}\) để oxy hóa toàn bộ \(\mathrm{Mn}^{2+}\) thành \(\mathrm{MnO}_{2}\) kết tủa theo phản ứng:
\(3 \mathrm{Mn}^{2+}+2 \mathrm{MnO}_{4}^{-}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow 5 \mathrm{MnO}_{2}+4 \mathrm{H}^{+}\)
Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ \(\mathrm{MnO}_{2}\) được loại bỏ. Hàm lượng manganese trong mẫu nước này cao gấp bao nhiêu lần so với ngưỡng cho phép? (Làm tròn kết quả đến hàng đơn vị)















