Đốt cháy hoàn toàn một mẩu dây sắt trong khí chlorine dư. Sau phản ứng thu được 42,12 gam chất rắn màu nâu đỏ. Khối lượng của mẩu dây sắt ban đầu là
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Đáp án đúng: B
Phản ứng cháy của sắt trong khí \(\mathrm{Cl}_{2}\) tạo thành iron(III) chloride: \(2 \mathrm{Fe}+3 \mathrm{Cl}_{2} \rightarrow 2 \mathrm{FeCl}_{3}\) .
Khối lượng chất rắn thu được sau phản ứng là khối lượng của \(\mathrm{FeCl}_{3}\). \(n_{\mathrm{FeCl}_{3}}=\frac{42,12}{162}=0,26 \mathrm{mol}\) \(\Rightarrow n_{F e}=n_{\text {FeCl }_{3}}=0,26 \mathrm{mol}\) \(\Rightarrow m_{F e}=0,26 \cdot 56=14,56\) gam .
Bộ Đề Kiểm Tra Học Kì II - Hóa Học 10 - Chân Trời Sáng Tạo - Bộ Đề 01 được thiết kế để ôn tập cho học sinh lớp 10 chuẩn bị bài kiểm tra cuối học kỳ II, bao gồm nhiều dạng câu hỏi đa dạng, từ trắc nghiệm đến câu hỏi trả lời ngắn và câu hỏi lý thuyết. Các đề thi này tập trung vào các chủ đề quan trọng trong chương trình Hóa học lớp 10 như số oxi hóa, phản ứng oxi hóa - khử, enthalpy, và các phương pháp điều chế chất. Đặc biệt, các câu hỏi được xây dựng để giúp các em học sinh nắm vững kiến thức lý thuyết và kỹ năng giải bài tập, đồng thời khuyến khích tư duy phản biện và áp dụng kiến thức vào thực tế. Các đề thi cũng cung cấp hướng dẫn chi tiết về cách giải các bài tập hóa học, giúp các em không chỉ ôn tập mà còn cải thiện kỹ năng giải quyết vấn đề.
Câu hỏi liên quan
Trong phòng thí nghiệm, một học sinh nhúng thanh Cu có khối lượng 12,340 gam vào 256 mL dung dịch \(\mathrm{AgNO}_{3} 0,125 \mathrm{M}\). Sau một thời gian, lấy thanh Cu đem sấy khô và cân lại có khối lượng 12,492 gam. Khối lượng Ag sinh ra là bao nhiêu, nếu giả thiết rằng toàn bộ lượng Ag giải phóng đều bám vào thanh đồng.
Theo QCVN 01-1:2018/BYT, hàm lượng manganese (Mn) tối đa cho phép trong nước sinh hoạt không được vượt quá \(0,3 \mathrm{mg} / \mathrm{L}\). Một mẫu nước chứa \(\mathrm{Mn}^{2+}\) với nồng độ chưa xác định. Để đánh giá hàm lượng manganese trong \(5 \mathrm{m}^{3}\) mẫu nước trên, người ta tiến hành tách loại manganese bằng cách sử dụng 50 gam \(\mathrm{KMnO}_{4}\) để oxy hóa toàn bộ \(\mathrm{Mn}^{2+}\) thành \(\mathrm{MnO}_{2}\) kết tủa theo phản ứng:
\(3 \mathrm{Mn}^{2+}+2 \mathrm{MnO}_{4}^{-}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow 5 \mathrm{MnO}_{2}+4 \mathrm{H}^{+}\)
Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ \(\mathrm{MnO}_{2}\) được loại bỏ. Hàm lượng manganese trong mẫu nước này cao gấp bao nhiêu lần so với ngưỡng cho phép? (Làm tròn kết quả đến hàng đơn vị)
Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. Câu 1. Nhúng thanh Cu tinh khiết có khối lượng là \(\mathrm{m}_{1}(\mathrm{gam})\) vào dung dịch iron(III) chloride, sau một thời gian, lấy thanh Cu ra cân lại thấy khối lượng là \(\mathrm{m}_{2}(\mathrm{gam})\). Cho các phát biểu sau:
Xét phản ứng sau:
\(\mathrm{Fe}_{2} \mathrm{O}_{3}+3 \mathrm{CO} \rightarrow 2 \mathrm{Fe}+3 \mathrm{CO}_{2}\)
Phương trình biểu diễn quá trình khử của phản ứng trên là
Nồng độ ion \(\mathrm{NO}_{3}{ }^{-}\)trong nước uống tối đa cho phép là 9 ppm (part per million - phần triệu). Nếu thừa ion này sẽ gây ra một loại bệnh thiếu máu hoặc tạo thành nitrosamin (một hợp chất gây ung thư đường tiêu hóa). Để xác định hàm lượng ion \(\mathrm{NO}_{3}{ }^{-}\)trong 200 mL nước người ta dùng các hoá chất ( \(\mathrm{Cu}+\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng) thấy cần dùng đến \(1,92 \mathrm{mg} \mathrm{Cu}\). Hàm lượng \(\mathrm{NO}_{3}{ }^{-}\)trong mẫu nước trên là bao nhiêu?
Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Người ta có thể xác định hàm lượng ethanol bằng xét nghiệm máu hoặc đo hơi thở bằng máy đo (có chứa hỗn hợp \(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\) và \(\mathrm{H}_{2} \mathrm{SO}_{4}\) ) theo phương trình như sau:
\(\mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{OH}+\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{CH}_{3} \mathrm{COOH}+\mathrm{Cr}_{2}\left(\mathrm{SO}_{4}\right)_{3}+\mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{H}_{2} \mathrm{O}\)
Khi chuẩn độ 25,0 gam huyết tương máu của một người lái xe cần dùng \(20,0 \mathrm{~mL}\) dung dịch \(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7} 0,010 \mathrm{M}\). Nồng độ phần trăm ethanol trong 25 gam huyết tương máu của một người lái xe là
Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 \(\mathrm{mg} / \mathrm{L}\) (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật).
Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: \(\mathrm{Cl}_{2}+2 \mathrm{KI} \longrightarrow \mathrm{KCl}+\mathrm{I}_{2}\).
Lượng \(\mathrm{I}_{2}\) sau đó được được nhận biết bằng hồ tinh bột, \(\mathrm{I}_{2}\) bị khử bởi dung dịch chuẩn sodium thiosul \(\mathfrak{f}\) ate theo phương trình: \(\mathrm{I}_{2}+2 \mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3} \longrightarrow 2 \mathrm{NaI}+\mathrm{Na}_{2} \mathrm{~S}_{4} \mathrm{O}_{6}\).
Dựa vào thể tích dung dịch \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) đã phản ứng, tính được dư lượng chlorine trong dung dịch mẫu. Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) 0,01 M thì thể tích \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) đã dùng trong lần chuẩn độ lần lượt như sau:
(dụng cụ chứa dung dịch chuẩn \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) là loại buret 25 mL , vạch chia \(0,1 \mathrm{~mL}\) ). Tính lượng \(\mathrm{Cl}_{2}\) trong mẫu sản phẩm trên.
Một số loại máy đo nồng độ cồn trong hơi thở dựa trên phản ứng của ethanol (cồn) có trong hơi thở với hợp chất potassium dichromate trong môi trường sulfuric acid loãng. Dung dịch chứa ion \(\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\) có màu da cam, khi xảy ra phản ứng dưới tác dụng của chất xúc tác ion \(\mathrm{Ag}^{+}\)tạo thành dung dịch chứa ion \(\mathrm{Cr}^{3+}\) có màu xanh lá cây. Dựa vào sự thay đổi màu sắc này có thể xác định người tham gia giao thông có sử dụng thức uống có cồn hay không.
Bảng (trích từ nghị định 168/2024/NĐ-CP) đưa ra mức độ phạt người tham gia giao thông có sử dụng hàm lượng cồn.Mức độ
vi phạm
≤ 0,25 mg cồn
/1 lít khí thở
0,25 – 0,4 mg cồn
/1 lít khí thở
> 0,4 mg cồn
/1 lít khí thở
Xe máy
Phạt tiền từ 2 triệu đồng đến 3 triệu đồng
Phạt tiền từ 6 triệu đồng đến 8 triệu đồng
Phạt tiền từ 8 triệu đồng đến 10 triệu đồng
Một mẫu hơi thở của người bị nghi vấn có sử dụng cồn khi tham gia giao thông có thể tích \(52,5 \mathrm{~mL}\) được thổi vào thiết bị Breathalyzer chứa \(2,0 \mathrm{~mL}\) dung dịch \(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\) nồng độ \(0,056 \mathrm{mg} / \mathrm{mL}\) trong môi trường acid \(\mathrm{H}_{2} \mathrm{SO}_{4} 50 \%\) và nồng độ ion \(\mathrm{Ag}^{+}\) ổn định \(0,25 \mathrm{mg} / \mathrm{mL}\). Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ dung dịch màu da cam chuyển hoàn toàn thành màu xanh lá cây. Kết luận nào sau đây đúng dành cho người bị nghi vấn có sử dụng cồn?
\(\mathbf{M}\) là muối ngậm nước của sắt có công thức \(\mathrm{FeC}_{2} \mathrm{O}_{4} . \mathrm{xH}_{2} \mathrm{O}\). Để xác định x người ta chuẩn độ bằng dung dịch \(\mathrm{KMnO}_{4}\) trong môi trường acid \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng và được đun nóng đến \(70^{\circ} \mathrm{C}\). Lấy \(2,6235 \ \mathrm{gam} \mathbf{M}\) hoà tan vào acid \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng và cho thêm nước vào để được 250 mL dung dịch. Lấy \(25,00 \mathrm{mL}\) dung dịch này đem chuẩn độ bằng dung dịch \(\mathrm{KMnO}_{4} 0,020 \mathrm{M}\). Kết quả trung bình của 3 lần chuẩn độ cho thấy thể tích \(\mathrm{KMnO}_{4}\) tiêu tốn là \(29,15 \mathrm{mL}\). Phản ứng xảy ra như sau:
\(\mathrm{FeC}_{2} \mathrm{O}_{4}+\mathrm{KMnO}_{4}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}+\mathrm{MnSO}_{4}+\mathrm{CO}_{2}+\mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{H}_{2} \mathrm{O}\)
Giá trị của x là bao nhiêu?
Xét phản ứng sau: \(3 \mathrm{HCl}+\mathrm{HNO}_{3} \rightarrow \mathrm{Cl}_{2}+\mathrm{NOCl}+2 \mathrm{H}_{2} \mathrm{O}\) Chất khử trong phản ứng trên là
Trong phòng thí nghiệm, có một mẫu dung dịch \(\mathrm{Sn}^{2+}\) có nồng độ \(\mathrm{x}(\mathrm{mol} / \mathrm{L})\). Để xác định nồng độ của dung dịch, người ta cho 100 mL dung dịch chứa ion trên tác dụng với dung dịch chứa \(\mathrm{Ce}^{4+} 0,1050 \mathrm{M}\) thì thấy cần dùng \(46,45 \mathrm{mL}\) dung dịch chứa \(\mathrm{Ce}^{4+}\) (đã thực hiện 3 lần và giá trị thể tích là trung bình). Hãy tính giá trị của 1000 x. (làm tròn đáp án đến hàng đơn vị). Biết rằng ion \(\mathrm{Ce}^{4+}\) có thể oxi hóa ion \(\mathrm{Sn}^{2+}\) lên \(\mathrm{Sn}^{4+}\) và nó bị khử xuống \(\mathrm{Ce}^{3+}\).
Muối Mohr có công thức \(\left(\mathrm{NH}_{4}\right)_{2} \mathrm{Fe}\left(\mathrm{SO}_{4}\right)_{2} \cdot 6 \mathrm{H}_{2} \mathrm{O}\). Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X , thêm 10 mL dung dịch \(\mathrm{H}_{2} \mathrm{SO}_{4} 10 \%\), được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn \(\mathrm{KMnO}_{4} 0,023 \mathrm{M}\). Thực hiện chuẩn độ 3 lần.
Kết quả đạt được như sau:
Lần chuẩn độ
1
2
3
Thể tích dung dịch KMnO4 (mL)
16,0
16,1
16,0
Cho các phát biểu sau:
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây là sai?
Cho thế điện cực chuẩn của các cặp oxi hóa - khử sau:\(\mathrm{E}_{\mathrm{MnO}_{4}^{-} / \mathrm{Mn}^{2+}}^{0}=+1,51 \mathrm{V}\) và \(\mathrm{E}_{\mathrm{Fe}^{3+} / \mathrm{Fe}^{2+}}^{0}=+0,77 \mathrm{V}\)
Phát biểu nào sau đây sai?
Trước đây, tinh thể copper(II) sulfate được "nuôi" như sau:
Bước 1: Cho dung dịch sulfuric acid loãng vào cốc thuỷ tinh.
Bước 2: Đun nóng dung dịch acid.
Bước 3: Thêm copper (II) oxide vào đến dư.
Bước 4: Đợi phản ứng xảy ra hoàn toàn rồi lọc hỗn hợp thu được.
Bước 5: Làm bay hơi nước lọc cho đến khi tinh thể xuất hiện trong cốc.
Bước 6: Làm mát cốc nước lọc.
Cho các phát biểu sau:
Sự cố tràn dầu thường xảy ra trong các hoạt động tìm kiếm, thăm dò, khai thác, vận chuyển, chế biến, phân phối và tàng trữ dầu khí và các sản phẩm của chúng. Ví dụ: các hiện tượng rò rỉ, phụt dầu, vỡ đường ống, vỡ bể chứa, tai nạn đâm và gây thủng tàu, sự cố tại các khoan dầu khí, nhà máy lọc hóa dầu ….
Ở Hình 9.6, Hình 9.7 và Hình 9.8 là các cách xử lý do sự cố tràn dầu. Hiện nay các nước sử dụng giải pháp nào có hiệu quả để hạn chế sự lan ra xung quanh của dầu khi xảy ra sự cố tràn dầu trên mặt biển?
Cho công thức cấu tạo của tetrathionic acid \(\left(\mathrm{H}_{2} \mathrm{S}_{4} \mathrm{O}_{6}\right)\) như sau:
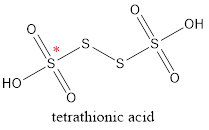
Số oxi hóa của nguyên tử sulfur được đánh dấu (*) trong tetrathionic acid là
Một viên thực phẩm chức năng có khối lượng 250 mg trước nguyên tố sắt ở dạng muối Fe (II) cùng một số chất khác. Kết quả kiểm nghiệm thấy lượng Fe(II) trong viên này phản ứng vừa đủ với 8,5 mL dung dịch \(\mathrm{KMnO}_{4} 0,04 \mathrm{M}\). Phần trăm khối lượng của nguyên tố sắt trong viên thực phẩm chức năng trên là bao nhiêu? (Làm tròn kết quả đến hàng phần muời).
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá – khử sau:
Số kim loại trong dãy các kim loại Zn, Ni, Fe, Cu phản ứng được với dung dịch HCl ở điều kiện chuẩn là
Cho các cặp oxi hóa - khử và giá trị thế điện cực chuẩn tương ứng sau:
Cặp oxi hóa khử
X2+/X
Y2+/Y
Z2+/Z
T2+/T
E+/E
Thế điện cực chuẩn (V)
0,340
-2,356
-0,440
0,854
0,799
Dãy sắp xếp các ion theo thứ tự tính oxi hóa tăng dần là















