Cho phản ứng hóa học: \(\mathrm{Zn}+\mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2} \longrightarrow \mathrm{Zn}\left(\mathrm{NO}_{3}\right)_{2}+\mathrm{Cu}\). Trong phản ứng trên xảy ra các quá trình là
Tuyển Tập Đề Thi Tham Khảo Tốt Nghiệp THPT Năm 2025 - Hóa Học - Bộ Đề 06 giúp học sinh lớp 12 ôn tập hiệu quả và tự tin bước vào kỳ thi Tốt nghiệp THPT năm 2025. Mỗi đề thi trong tài liệu được xây dựng theo đúng cấu trúc chuẩn của Bộ Giáo dục và Đào tạo, bao gồm ba phần: trắc nghiệm nhiều lựa chọn, trắc nghiệm đúng – sai và trắc nghiệm trả lời ngắn. Các câu hỏi được chọn lọc kỹ lưỡng, bám sát nội dung chương trình, tích hợp kiến thức liên môn và có độ phân hóa phù hợp, giúp học sinh không chỉ ôn tập lý thuyết mà còn rèn luyện kỹ năng giải đề thực tiễn. Đặc biệt, phần đáp án và hướng dẫn giải chi tiết đi kèm giúp học sinh dễ dàng tự đánh giá kết quả và nhận diện các dạng bài quan trọng.
Câu hỏi liên quan
Để tăng hiệu quả tẩy trắng của bột giặt người ta thường cho thêm vào một ít bột sodium peroxide \(\left(\mathrm{Na}_{2} \mathrm{O}_{2}\right)\), vì sodium peroxide khi tác dụng với nước sẽ sinh ra \(\mathrm{H}_{2} \mathrm{O}_{2}\) là một chất oxi hóa mạnh có thể tẩy trắng được quần áo. Cách nào sau đây là cách tốt nhất để bảo quản bột giặt?
Vỏ trứng có chứa calcium ở dạng \(\mathrm{CaCO}_{3}\). Để xác định hàm lượng \(\mathrm{CaCO}_{3}\) trong vỏ trứng, các bước thí nghiệm được tiến hành như sau:
Bước 1: Cân 2,0 gam vỏ trứng khô, đã làm sạch, hoà tan hoàn toàn trong 50 mL dung dịch \(\mathrm{HCl} 0,1 \mathrm{M}\). Lọc dung dịch sau phản ứng thu được 50 mL dung dịch X .
Bước 2; Chuẩn độ \(10,0 \mathrm{~mL}\) dung dịch X bằng dung dịch NaOH chuẩn với chỉ thị phenolphthalein thì tại điểm kết thúc chuẩn độ, dung dịch xuất hiện màu hồng.
Kết quả chuẩn độ \(10,0 \mathrm{~mL}\) dung dịch X khi sử dụng dung dịch chuẩn \(\mathrm{NaOH} \ 0,01 \mathrm{M}\) được ghi trong bảng sau:
Giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl , chấp nhận sai số chuẩn độ không đáng kể, các thành phần khác trong vỏ trứng không ảnh hưởng đến kết quả chuẩn độ. Tính hàm lượng \(\mathrm{CaCO}_{3}\) trong vỏ trứng.
Thực hiện thí nghiệm sau: lấy 5,2 gam một mẫu bột oxide sắt và cho đủ lượng carbon monoxide, thực hiện phản ứng ở nhiệt độ cao, đến khi thu được kim loại Fe và khí X. Cho khí X sinh ra qua nước vôi trong dư thì thu được 8,00 gam kết tủa trắng. Tỷ lệ mol của Fe và O trong mẫu oxide Fe là
Muối Mohr có công thức \(\left(\mathrm{NH}_{4}\right)_{2} \mathrm{Fe}\left(\mathrm{SO}_{4}\right)_{2} \cdot 6 \mathrm{H}_{2} \mathrm{O}\). Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X , thêm 10 mL dung dịch \(\mathrm{H}_{2} \mathrm{SO}_{4} 10 \%\), được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn \(\mathrm{KMnO}_{4} 0,023 \mathrm{M}\). Thực hiện chuẩn độ 3 lần.
Kết quả đạt được như sau:
Lần chuẩn độ
1
2
3
Thể tích dung dịch KMnO4 (mL)
16,0
16,1
16,0
Cho các phát biểu sau:
Quá trình nào sau đây xảy hiện tượng hóa học?
Trong hợp chất \(\mathrm{Na}_{2} \mathrm{SO}_{4}\), số oxi hóa của sulfur là
Tất cả các huy chương Olympics London 2012 đều có đường kính 85 mm và độ dày 7 mm . Các huy chương Đồng được làm bằng hợp kim chứa copper. Tiến hành quy trình phân tích định lượng sau để xác định thành phần hợp kim: Hòa \(\tan 0,800 \mathrm{~g}\) mẫu huy chương Đồng vào dung dịch nitric acid đậm đặc, nóng. Sau khi làm nguội và pha loãng, thêm một lượng dư dung dịch potassium iodide vào rồi tiếp tục pha loãng dung dịch đến \(250,0 \mathrm{~cm}^{3}\). Biết \(25,00 \mathrm{~cm}^{3}\) mẫu dung dịch này phản ứng vừa đủ với \(12,20 \mathrm{~cm}^{3}\) dung dịch sodium thiosulfate \(0,100 \mathrm{M}\).
Cho các phương trình xảy ra như sau:
Tính hàm lượng đồng trong chiếc huy chương đồng.
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây là sai?
Để dập tắt các đám cháy do xăng dầu gây ra, người ta dùng cát hoặc bột chữa cháy \(\mathrm{MAP}\left(\mathrm{NH}_{4} \mathrm{H}_{2} \mathrm{PO}_{4}\right)\) mà không dùng nước. Cho các phát biểu sau:
(a) Xăng dầu nhẹ hơn nước và không tan trong nước nên nếu dùng nước xăng dầu sẽ nổi lên trên làm cho càng dễ cháy hơn.
(b) Cát hoặc bột chữa cháy MAP có tác dụng tạo lớp phủ bề mặt ngăn xăng dầu tiếp xúc với oxygen trong không khí.
(c) Quá trình nước bay hơi là quá trình tỏa nhiệt nên đám cháy xảy ra càng mạnh.
(d) Cát hoặc bột chữa cháy MAP hấp thụ nhiệt nên làm giảm nhiệt độ ngăn cản đám cháy.
Có bao nhiêu phát biểu sai?
Nối dung dịch sodium chloride với nguồn điện và một bóng đèn nhỏ. Quan sát thấy bóng đèn
Cho các cặp oxi hóa - khử và giá trị thế điện cực chuẩn tương ứng sau:
Cặp oxi hóa khử
X2+/X
Y2+/Y
Z2+/Z
T2+/T
E+/E
Thế điện cực chuẩn (V)
0,340
-2,356
-0,440
0,854
0,799
Dãy sắp xếp các ion theo thứ tự tính oxi hóa tăng dần là
Trong phương pháp phân tích nhiệt, một chất rắn khối lượng \(\mathrm{m}_{1}\) được gia nhiệt, thu được chất rắn mới khối lượng \(\mathrm{m}_{2}\) (khối lượng \(\mathrm{m}_{2}\) thay đổi theo từng giai đoạn phản ứng) và chất khí hoặc hơi. Giản đồ phân tích nhiệt hình bên cho biết sự biến đổi khối lượng của calcium oxalate ngậm nước \(\mathrm{CaC}_{2} \mathrm{O}_{4} . \mathrm{H}_{2} \mathrm{O}\) trong môi trường khí trơ theo nhiệt độ: trục tung biểu thị phần trăm khối lượng chất rắn còn lại so với khối lượng ban đầu (\%); trục hoành biểu thị nhiệt độ nung.
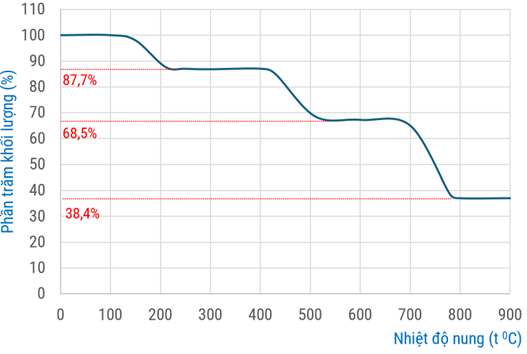
Cho các phương trình hóa học (theo đúng tỷ lệ mol) ứng với ba giai đoạn phản ứng có kèm theo thay đổi khối lượng của các chất rắn như sau:
(1) \(\mathrm{CaC}_{2} \mathrm{O}_{4} . \mathrm{H}_{2} \mathrm{O} \xrightarrow{\text { nung } 200^{\circ} \mathrm{C}} \mathrm{X}_{1(\mathrm{s})}+\mathrm{Y}_{1(\mathrm{g})}\)
(2) \(X_{1(\mathrm{s})} \xrightarrow{\text { nung } 510^{\circ} \mathrm{C}} X_{2(\mathrm{s})}+Y_{2(\mathrm{g})}\)
(3) \(\mathrm{X}_{2(\mathrm{s})} \xrightarrow{\text { nung } 780^{\circ} \mathrm{C}} \mathrm{X}_{3(\mathrm{s})}+\mathrm{Y}_{3(\mathrm{g})}\)
Phân tử khối của \(Y_{3}\) bằng bao nhiêu?
Chromium có số oxi hóa là +3 trong hợp chất nào sau đây?
Theo QCVN 01-1:2018/BYT, hàm lượng manganese (Mn) tối đa cho phép trong nước sinh hoạt không được vượt quá \(0,3 \mathrm{mg} / \mathrm{L}\). Một mẫu nước chứa \(\mathrm{Mn}^{2+}\) với nồng độ chưa xác định. Để đánh giá hàm lượng manganese trong \(5 \mathrm{m}^{3}\) mẫu nước trên, người ta tiến hành tách loại manganese bằng cách sử dụng 50 gam \(\mathrm{KMnO}_{4}\) để oxy hóa toàn bộ \(\mathrm{Mn}^{2+}\) thành \(\mathrm{MnO}_{2}\) kết tủa theo phản ứng:
\(3 \mathrm{Mn}^{2+}+2 \mathrm{MnO}_{4}^{-}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow 5 \mathrm{MnO}_{2}+4 \mathrm{H}^{+}\)
Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ \(\mathrm{MnO}_{2}\) được loại bỏ. Hàm lượng manganese trong mẫu nước này cao gấp bao nhiêu lần so với ngưỡng cho phép? (Làm tròn kết quả đến hàng đơn vị)
Nồng độ ion \(\mathrm{NO}_{3}{ }^{-}\)trong nước uống tối đa cho phép là 9 ppm (part per million - phần triệu). Nếu thừa ion này sẽ gây ra một loại bệnh thiếu máu hoặc tạo thành nitrosamin (một hợp chất gây ung thư đường tiêu hóa). Để xác định hàm lượng ion \(\mathrm{NO}_{3}{ }^{-}\)trong 200 mL nước người ta dùng các hoá chất ( \(\mathrm{Cu}+\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng) thấy cần dùng đến \(1,92 \mathrm{mg} \mathrm{Cu}\). Hàm lượng \(\mathrm{NO}_{3}{ }^{-}\)trong mẫu nước trên là bao nhiêu?
Xét phản ứng sau:
\(\mathrm{aKMnO}_{4}+\mathrm{bKI}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{xI}_{2}+\mathrm{yMnO}_{2}+\mathrm{zKOH}\)
Giá trị của \(\mathrm{x}, \mathrm{y}\) và z trong phản ứng này lần lượt là
Xét phản ứng sau: \(3 \mathrm{HCl}+\mathrm{HNO}_{3} \rightarrow \mathrm{Cl}_{2}+\mathrm{NOCl}+2 \mathrm{H}_{2} \mathrm{O}\) Chất khử trong phản ứng trên là
Ion nào sau đây có tính oxi hoá mạnh nhất ở điều kiện chuẩn?
Theo lý thuyết công thức của quặng pyrite là \(\mathrm{FeS}_{2}\). Thực tế một phân ion disulfide \(\mathrm{S}_{2}{ }^{-}\)bị thay thế bởi ion sulfide \(\left(\mathrm{S}^{2-}\right)\) nên coi pyrite như một hỗn hợp của \(\mathrm{FeS}_{2}\) và FeS. Như vậy, công thức tổng quát của pyrite có thể biểu diễn là \(\mathrm{FeS}_{\mathrm{x}}\) ). Khi xử lí m gam một mẫu pyrite (chỉ gồm \(\mathrm{FeS}_{2}\) và FeS ) bằng bromine trong dung dịch KOH dư người ta thu được kết tủa nâu đỏ A và dung dịch B. Nung kết tủa A đến khối lượng không đổi thu được 0,4 gam chất rắn. Thêm lượng dư dung dịch \(\mathrm{BaCl}_{2}\) vào dung dịch B thì thu được 2,2174 gam kết tủa trắng không tan trong acid. Xác định giá trị x trong công thức tổng quát \(\mathrm{FeS}_{\mathrm{x}}\) của quặng pyrite.
Nhiệt luyện thép chính là quá trình điều chế sắt từ quặng hematite bằng cách khử oxide của sắt ở nhiệt độ cao trong lò luyện kim.
Phản ứng xảy ra như sau: \(\mathrm{Fe}_{2} \mathrm{O}_{3}+\mathrm{xCO} \rightarrow \mathrm{yFe}+\mathrm{zCO}_{2}\)















