Xét phản ứng sau:
\(\mathrm{aKMnO}_{4}+\mathrm{bKI}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{xI}_{2}+\mathrm{yMnO}_{2}+\mathrm{zKOH}\)
Giá trị của \(\mathrm{x}, \mathrm{y}\) và z trong phản ứng này lần lượt là
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Đáp án đúng: A
Xét phản ứng:
\(\mathrm{aKMnO}_{4}+\mathrm{bKI}+\mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{xI}_{2}+\mathrm{yMnO}_{2}+\mathrm{zKOH}\)
Quá trình khử của manganese và oxi hóa của iodine:
Phương trình cân bằng:
\(2 \mathrm{KMnO}_{4}+6 \mathrm{KI}+\mathrm{H}_{2} \mathrm{O} \rightarrow 3 \mathrm{I}_{2}+2 \mathrm{MnO}_{2}+8 \mathrm{KOH}\)
Vậy \(x=3, y=2, z=8\).
Bộ Đề Kiểm Tra Học Kì II - Hóa Học 10 - Chân Trời Sáng Tạo - Bộ Đề 01 được thiết kế để ôn tập cho học sinh lớp 10 chuẩn bị bài kiểm tra cuối học kỳ II, bao gồm nhiều dạng câu hỏi đa dạng, từ trắc nghiệm đến câu hỏi trả lời ngắn và câu hỏi lý thuyết. Các đề thi này tập trung vào các chủ đề quan trọng trong chương trình Hóa học lớp 10 như số oxi hóa, phản ứng oxi hóa - khử, enthalpy, và các phương pháp điều chế chất. Đặc biệt, các câu hỏi được xây dựng để giúp các em học sinh nắm vững kiến thức lý thuyết và kỹ năng giải bài tập, đồng thời khuyến khích tư duy phản biện và áp dụng kiến thức vào thực tế. Các đề thi cũng cung cấp hướng dẫn chi tiết về cách giải các bài tập hóa học, giúp các em không chỉ ôn tập mà còn cải thiện kỹ năng giải quyết vấn đề.
Câu hỏi liên quan
Xét phản ứng sau: \(3 \mathrm{HCl}+\mathrm{HNO}_{3} \rightarrow \mathrm{Cl}_{2}+\mathrm{NOCl}+2 \mathrm{H}_{2} \mathrm{O}\) Chất khử trong phản ứng trên là
Hòa tan 4,875 gam kim loại M (có hóa trị 2) trong HNO3 loãng, dư thì thu được 0,05 mol NO (sản phẩm khử duy nhất). Kim loại M là
Các vụ hỏa hoạn ở các chung cư và nhà cao tầng hiện đang xảy ra liên tục với quy mô và mức độ tổn thất ngày càng cao. Các nạn nhân bị tử vong trong các vụ hỏa hoạn có thể do ngạt khí, bỏng nhiệt, nhảy từ trên cao xuống đất, bị vật nặng đè, giẫm đạp,... và số người chết thường không tập trung nhiều ở tâm đám cháy mà thường tập trung nhiều ở những nơi tích tụ khói hoặc có luồng khói đi qua. Khói từ đám cháy chứa các khí độc như carbon monoxide \((\mathrm{CO})\), hydrogen cyanide \((\mathrm{HCN})\) và các khí gây kích ứng khác.
Cho các phát biểu sau :
Để tăng hiệu quả tẩy trắng của bột giặt người ta thường cho thêm vào một ít bột sodium peroxide \(\left(\mathrm{Na}_{2} \mathrm{O}_{2}\right)\), vì sodium peroxide khi tác dụng với nước sẽ sinh ra \(\mathrm{H}_{2} \mathrm{O}_{2}\) là một chất oxi hóa mạnh có thể tẩy trắng được quần áo. Cách nào sau đây là cách tốt nhất để bảo quản bột giặt?
Chất nào sau đây có thể oxi hóa Zn thành \(\mathrm{Zn}^{2+}\) ?
Nhiệt luyện thép chính là quá trình điều chế sắt từ quặng hematite bằng cách khử oxide của sắt ở nhiệt độ cao trong lò luyện kim.
Phản ứng xảy ra như sau: \(\mathrm{Fe}_{2} \mathrm{O}_{3}+\mathrm{xCO} \rightarrow \mathrm{yFe}+\mathrm{zCO}_{2}\)
Theo lý thuyết công thức của quặng pyrite là \(\mathrm{FeS}_{2}\). Thực tế một phân ion disulfide \(\mathrm{S}_{2}{ }^{-}\)bị thay thế bởi ion sulfide \(\left(\mathrm{S}^{2-}\right)\) nên coi pyrite như một hỗn hợp của \(\mathrm{FeS}_{2}\) và FeS. Như vậy, công thức tổng quát của pyrite có thể biểu diễn là \(\mathrm{FeS}_{\mathrm{x}}\) ). Khi xử lí m gam một mẫu pyrite (chỉ gồm \(\mathrm{FeS}_{2}\) và FeS ) bằng bromine trong dung dịch KOH dư người ta thu được kết tủa nâu đỏ A và dung dịch B. Nung kết tủa A đến khối lượng không đổi thu được 0,4 gam chất rắn. Thêm lượng dư dung dịch \(\mathrm{BaCl}_{2}\) vào dung dịch B thì thu được 2,2174 gam kết tủa trắng không tan trong acid. Xác định giá trị x trong công thức tổng quát \(\mathrm{FeS}_{\mathrm{x}}\) của quặng pyrite.
Trong phòng thí nghiệm, một học sinh nhúng thanh Cu có khối lượng 12,340 gam vào 256 mL dung dịch \(\mathrm{AgNO}_{3} 0,125 \mathrm{M}\). Sau một thời gian, lấy thanh Cu đem sấy khô và cân lại có khối lượng 12,492 gam. Khối lượng Ag sinh ra là bao nhiêu, nếu giả thiết rằng toàn bộ lượng Ag giải phóng đều bám vào thanh đồng.
Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá – khử sau:
Số kim loại trong dãy các kim loại Zn, Ni, Fe, Cu phản ứng được với dung dịch HCl ở điều kiện chuẩn là
Theo QCVN 01-1:2018/BYT, hàm lượng manganese (Mn) tối đa cho phép trong nước sinh hoạt không được vượt quá \(0,3 \mathrm{mg} / \mathrm{L}\). Một mẫu nước chứa \(\mathrm{Mn}^{2+}\) với nồng độ chưa xác định. Để đánh giá hàm lượng manganese trong \(5 \mathrm{m}^{3}\) mẫu nước trên, người ta tiến hành tách loại manganese bằng cách sử dụng 50 gam \(\mathrm{KMnO}_{4}\) để oxy hóa toàn bộ \(\mathrm{Mn}^{2+}\) thành \(\mathrm{MnO}_{2}\) kết tủa theo phản ứng:
\(3 \mathrm{Mn}^{2+}+2 \mathrm{MnO}_{4}^{-}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow 5 \mathrm{MnO}_{2}+4 \mathrm{H}^{+}\)
Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ \(\mathrm{MnO}_{2}\) được loại bỏ. Hàm lượng manganese trong mẫu nước này cao gấp bao nhiêu lần so với ngưỡng cho phép? (Làm tròn kết quả đến hàng đơn vị)
Một số loại máy đo nồng độ cồn trong hơi thở dựa trên phản ứng của ethanol (cồn) có trong hơi thở với hợp chất potassium dichromate trong môi trường sulfuric acid loãng. Dung dịch chứa ion \(\mathrm{Cr}_{2} \mathrm{O}_{7}^{2-}\) có màu da cam, khi xảy ra phản ứng dưới tác dụng của chất xúc tác ion \(\mathrm{Ag}^{+}\)tạo thành dung dịch chứa ion \(\mathrm{Cr}^{3+}\) có màu xanh lá cây. Dựa vào sự thay đổi màu sắc này có thể xác định người tham gia giao thông có sử dụng thức uống có cồn hay không.
Bảng (trích từ nghị định 168/2024/NĐ-CP) đưa ra mức độ phạt người tham gia giao thông có sử dụng hàm lượng cồn.Mức độ
vi phạm
≤ 0,25 mg cồn
/1 lít khí thở
0,25 – 0,4 mg cồn
/1 lít khí thở
> 0,4 mg cồn
/1 lít khí thở
Xe máy
Phạt tiền từ 2 triệu đồng đến 3 triệu đồng
Phạt tiền từ 6 triệu đồng đến 8 triệu đồng
Phạt tiền từ 8 triệu đồng đến 10 triệu đồng
Một mẫu hơi thở của người bị nghi vấn có sử dụng cồn khi tham gia giao thông có thể tích \(52,5 \mathrm{~mL}\) được thổi vào thiết bị Breathalyzer chứa \(2,0 \mathrm{~mL}\) dung dịch \(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\) nồng độ \(0,056 \mathrm{mg} / \mathrm{mL}\) trong môi trường acid \(\mathrm{H}_{2} \mathrm{SO}_{4} 50 \%\) và nồng độ ion \(\mathrm{Ag}^{+}\) ổn định \(0,25 \mathrm{mg} / \mathrm{mL}\). Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ dung dịch màu da cam chuyển hoàn toàn thành màu xanh lá cây. Kết luận nào sau đây đúng dành cho người bị nghi vấn có sử dụng cồn?
Để dập tắt các đám cháy do xăng dầu gây ra, người ta dùng cát hoặc bột chữa cháy \(\mathrm{MAP}\left(\mathrm{NH}_{4} \mathrm{H}_{2} \mathrm{PO}_{4}\right)\) mà không dùng nước. Cho các phát biểu sau:
(a) Xăng dầu nhẹ hơn nước và không tan trong nước nên nếu dùng nước xăng dầu sẽ nổi lên trên làm cho càng dễ cháy hơn.
(b) Cát hoặc bột chữa cháy MAP có tác dụng tạo lớp phủ bề mặt ngăn xăng dầu tiếp xúc với oxygen trong không khí.
(c) Quá trình nước bay hơi là quá trình tỏa nhiệt nên đám cháy xảy ra càng mạnh.
(d) Cát hoặc bột chữa cháy MAP hấp thụ nhiệt nên làm giảm nhiệt độ ngăn cản đám cháy.
Có bao nhiêu phát biểu sai?
Trong phương pháp phân tích nhiệt, một chất rắn khối lượng \(\mathrm{m}_{1}\) được gia nhiệt, thu được chất rắn mới khối lượng \(\mathrm{m}_{2}\) (khối lượng \(\mathrm{m}_{2}\) thay đổi theo từng giai đoạn phản ứng) và chất khí hoặc hơi. Giản đồ phân tích nhiệt hình bên cho biết sự biến đổi khối lượng của calcium oxalate ngậm nước \(\mathrm{CaC}_{2} \mathrm{O}_{4} . \mathrm{H}_{2} \mathrm{O}\) trong môi trường khí trơ theo nhiệt độ: trục tung biểu thị phần trăm khối lượng chất rắn còn lại so với khối lượng ban đầu (\%); trục hoành biểu thị nhiệt độ nung.
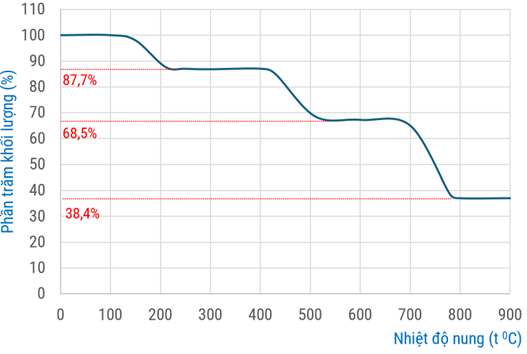
Cho các phương trình hóa học (theo đúng tỷ lệ mol) ứng với ba giai đoạn phản ứng có kèm theo thay đổi khối lượng của các chất rắn như sau:
(1) \(\mathrm{CaC}_{2} \mathrm{O}_{4} . \mathrm{H}_{2} \mathrm{O} \xrightarrow{\text { nung } 200^{\circ} \mathrm{C}} \mathrm{X}_{1(\mathrm{s})}+\mathrm{Y}_{1(\mathrm{g})}\)
(2) \(X_{1(\mathrm{s})} \xrightarrow{\text { nung } 510^{\circ} \mathrm{C}} X_{2(\mathrm{s})}+Y_{2(\mathrm{g})}\)
(3) \(\mathrm{X}_{2(\mathrm{s})} \xrightarrow{\text { nung } 780^{\circ} \mathrm{C}} \mathrm{X}_{3(\mathrm{s})}+\mathrm{Y}_{3(\mathrm{g})}\)
Phân tử khối của \(Y_{3}\) bằng bao nhiêu?
Vỏ trứng có chứa calcium ở dạng \(\mathrm{CaCO}_{3}\). Để xác định hàm lượng \(\mathrm{CaCO}_{3}\) trong vỏ trứng, các bước thí nghiệm được tiến hành như sau:
Bước 1: Cân 2,0 gam vỏ trứng khô, đã làm sạch, hoà tan hoàn toàn trong 50 mL dung dịch \(\mathrm{HCl} 0,1 \mathrm{M}\). Lọc dung dịch sau phản ứng thu được 50 mL dung dịch X .
Bước 2; Chuẩn độ \(10,0 \mathrm{~mL}\) dung dịch X bằng dung dịch NaOH chuẩn với chỉ thị phenolphthalein thì tại điểm kết thúc chuẩn độ, dung dịch xuất hiện màu hồng.
Kết quả chuẩn độ \(10,0 \mathrm{~mL}\) dung dịch X khi sử dụng dung dịch chuẩn \(\mathrm{NaOH} \ 0,01 \mathrm{M}\) được ghi trong bảng sau:
Giả thiết các tạp chất khác trong vỏ trứng không phản ứng với HCl , chấp nhận sai số chuẩn độ không đáng kể, các thành phần khác trong vỏ trứng không ảnh hưởng đến kết quả chuẩn độ. Tính hàm lượng \(\mathrm{CaCO}_{3}\) trong vỏ trứng.
Cho phản ứng chuẩn độ muối Mohr \(\left(\mathrm{FeSO}_{4} \cdot\left(\mathrm{NH}_{4}\right)_{2} \mathrm{SO}_{4} \cdot 6 \mathrm{H}_{2} \mathrm{O}\right)\) trong môi trường acid:
\(\mathrm{Cr}_{2} \mathrm{O}_{7}{ }^{2-}+14 \mathrm{H}^{+}+6 \mathrm{Fe}^{2+} \rightarrow 2 \mathrm{Cr}^{3+}+6 \mathrm{Fe}^{3+}+7 \mathrm{H}_{2} \mathrm{O}\)
Cần bao nhiêu milimol potassium dichromate để oxi hóa \(24 \mathrm{cm}^{3}\) dung dịch muối Mohr \(0,5 \mathrm{M}\) trong môi trường acid (làm tròn kết quả đến chữ số hàng đơn vị)?
Tất cả các huy chương Olympics London 2012 đều có đường kính 85 mm và độ dày 7 mm . Các huy chương Đồng được làm bằng hợp kim chứa copper. Tiến hành quy trình phân tích định lượng sau để xác định thành phần hợp kim: Hòa \(\tan 0,800 \mathrm{~g}\) mẫu huy chương Đồng vào dung dịch nitric acid đậm đặc, nóng. Sau khi làm nguội và pha loãng, thêm một lượng dư dung dịch potassium iodide vào rồi tiếp tục pha loãng dung dịch đến \(250,0 \mathrm{~cm}^{3}\). Biết \(25,00 \mathrm{~cm}^{3}\) mẫu dung dịch này phản ứng vừa đủ với \(12,20 \mathrm{~cm}^{3}\) dung dịch sodium thiosulfate \(0,100 \mathrm{M}\).
Cho các phương trình xảy ra như sau:
Tính hàm lượng đồng trong chiếc huy chương đồng.
Đốt cháy hoàn toàn một mẩu dây sắt trong khí chlorine dư. Sau phản ứng thu được 42,12 gam chất rắn màu nâu đỏ. Khối lượng của mẩu dây sắt ban đầu là
Muối Mohr có công thức \(\left(\mathrm{NH}_{4}\right)_{2} \mathrm{Fe}\left(\mathrm{SO}_{4}\right)_{2} \cdot 6 \mathrm{H}_{2} \mathrm{O}\). Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X , thêm 10 mL dung dịch \(\mathrm{H}_{2} \mathrm{SO}_{4} 10 \%\), được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn \(\mathrm{KMnO}_{4} 0,023 \mathrm{M}\). Thực hiện chuẩn độ 3 lần.
Kết quả đạt được như sau:
Lần chuẩn độ
1
2
3
Thể tích dung dịch KMnO4 (mL)
16,0
16,1
16,0
Cho các phát biểu sau:
\(\mathbf{M}\) là muối ngậm nước của sắt có công thức \(\mathrm{FeC}_{2} \mathrm{O}_{4} . \mathrm{xH}_{2} \mathrm{O}\). Để xác định x người ta chuẩn độ bằng dung dịch \(\mathrm{KMnO}_{4}\) trong môi trường acid \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng và được đun nóng đến \(70^{\circ} \mathrm{C}\). Lấy \(2,6235 \ \mathrm{gam} \mathbf{M}\) hoà tan vào acid \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng và cho thêm nước vào để được 250 mL dung dịch. Lấy \(25,00 \mathrm{mL}\) dung dịch này đem chuẩn độ bằng dung dịch \(\mathrm{KMnO}_{4} 0,020 \mathrm{M}\). Kết quả trung bình của 3 lần chuẩn độ cho thấy thể tích \(\mathrm{KMnO}_{4}\) tiêu tốn là \(29,15 \mathrm{mL}\). Phản ứng xảy ra như sau:
\(\mathrm{FeC}_{2} \mathrm{O}_{4}+\mathrm{KMnO}_{4}+\mathrm{H}_{2} \mathrm{SO}_{4} \rightarrow \mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}+\mathrm{MnSO}_{4}+\mathrm{CO}_{2}+\mathrm{K}_{2} \mathrm{SO}_{4}+\mathrm{H}_{2} \mathrm{O}\)
Giá trị của x là bao nhiêu?
Để phòng bệnh bướu cổ và một số bệnh khác, mỗi người cần bổ sung \(1,5.10^{-4}\) gam iodine mỗi ngày. Biết rằng muối i-ốt chứa 25 gam KI trong 1 tấn muối ăn. Nếu nguồn cung cấp iodine là KI, thì khối lượng muối i-ốt mà mỗi người cần tiêu thụ mỗi ngày là















