Cho phản ứng hóa học: \(\mathrm{CO}_{2}(\mathrm{~g}) \longrightarrow \mathrm{CO}(\mathrm{g})+\frac{1}{2} \mathrm{O}_{2}\) và các dữ kiện:
Biến thiên năng lượng tự do Gibbs chuẩn của phản ứng trên ở \(25^{\circ} \mathrm{C}\) là bao nhiêu?. (làm tròn đến hàng đơn vị)
Tuyển Tập Đề Thi Tham Khảo Tốt Nghiệp THPT Năm 2025 – Hóa Học – Bộ Đề 02 là tài liệu ôn tập quan trọng dành cho học sinh lớp 12, giúp các em rèn luyện kỹ năng làm bài và chuẩn bị tốt nhất cho kỳ thi tốt nghiệp THPT 2025. Bộ đề được biên soạn theo định hướng của Bộ GD ĐT, bám sát chương trình học, bao gồm các chủ đề trọng tâm như phản ứng oxi hóa - khử, điện hóa học, este – chất béo, amino axit – protein, kim loại và phi kim… Hệ thống câu hỏi trắc nghiệm đa dạng, được thiết kế theo nhiều mức độ từ nhận biết, thông hiểu đến vận dụng và vận dụng cao, giúp học sinh làm quen với cấu trúc đề thi và phát triển tư duy hóa học. Mỗi đề thi đều có đáp án chi tiết và hướng dẫn giải cụ thể, hỗ trợ học sinh tự đánh giá năng lực, xác định điểm mạnh và cải thiện điểm yếu trong quá trình ôn tập.
Câu hỏi liên quan
Acetylene thường được dùng làm nhiên liệu, ví dụ đèn xì oxygen - acetylene dùng để hàn cắt kim loại. Khí methane là thành phần chính của khí thiên nhiên cũng được sử dụng làm nhiên liệu. Methane và acetylene cháy theo phương trình hóa học sau:
CH4 (g) + 2 O2 (g) CO2 (g) + 2H2O (g) (1)
2C2H2 (g) + 5O2 (g) 4CO2 (g) + 2H2O (g) (2)
Cho biết nhiệt tạo thành chuẩn của một số chất như sau:
Chất
CH4 (g)
C2H2 (g)
CO2 (g)
H2O (g)
(kJ/mol)
- 74,6
227,4
- 393,5
- 241,8
Cho các phát biểu sau:
Phản ứng giữa ethane và chlorine tạo ra ethyl chloride và khí hydrogen chloride là phản ứng tỏa nhiệt. Phương trình phản ứng:
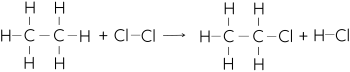
Cho biết năng lượng của một số liên kết như sau:
Liên kết
Năng lượng liên kết (kJ/mol)
C-Cl
+340
C-C
+350
C-H
+410
Cl-Cl
+240
H-Cl
+430
Biến thiên enthalpy chuẩn của phản ứng trên là bao nhiêu \(\mathrm{kJ} / \mathrm{mol}\) (làm tròn kết quả đến chư số hàng đơn vị)?
Biến thiên enthalpy \((\Delta \mathrm{H})\) có giá trị âm đối với loại phản ứng nào sau đây?
Khi các phản ứng dưới đây được thực hiện trong một buồng kín, phản ứng nào sẽ làm nhiệt độ trong buồng tăng lên?
Trong các quá trình sau, quá trình nào hấp thụ nhiệt từ môi trường?
Ở nhiệt độ cao, magnesium nitrate bị phân hủy theo phản ứng:
\(\mathrm{Mg}\left(\mathrm{NO}_{3}\right)_{2(\mathrm{~s})} \rightarrow \mathrm{MgO}_{(\mathrm{s})}+2 \mathrm{NO}_{2(\mathrm{~g})}+\frac{1}{2} \mathrm{O}_{2(\mathrm{~g})} \triangle_{\mathrm{r}} \mathrm{H}_{298}^{0}=?\)
Cho biết:
Biến thiên enthalpy chuẩn của phản ứng trên là bao nhiêu kJ? (Làm tròn kết quả đến hàng đơn vị).
Ở nhiệt độ cao, magnesium nitrate bị phân hủy theo phản ứng:
\(\mathrm{Mg}\left(\mathrm{NO}_{3}\right)_{2(\mathrm{~s})} \rightarrow \mathrm{MgO}_{(\mathrm{s})}+2 \mathrm{NO}_{2(\mathrm{~g})}+\frac{1}{2} \mathrm{O}_{2(\mathrm{~g})} \triangle_{\mathrm{r}} \mathrm{H}_{298}^{0}=?\)
Cho biết:
Biến thiên enthalpy chuẩn của phản ứng trên là bao nhiêu kJ? (Làm tròn kết quả đến hàng đơn vị).
Ethanol \(\left(\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}\right)\) là một loại nhiên liệu sinh học được sử dụng phổ biến. Khi cháy hoàn toàn, ethanol tạo ra \(\mathrm{CO}_{2}\) và \(\mathrm{H}_{2} \mathrm{O}\). Ngoài ra, trong một số quá trình công nghiệp, CO có thể bị oxi hóa thành \(\mathrm{CO}_{2}\). Cho hai phản ứng sau:
(1) \(\mathrm{C}_{2} \mathrm{H}_{5} \mathrm{OH}(\mathrm{l})+3 \mathrm{O}_{2}(\mathrm{g}) \rightarrow 2 \mathrm{CO}_{2}(\mathrm{g})+3 \mathrm{H}_{2} \mathrm{O}(\mathrm{l})\)
(2) \(\mathrm{CO}(\mathrm{g})+1 / 2 \mathrm{O}_{2}(\mathrm{g}) \rightarrow \mathrm{CO}_{2}(\mathrm{g})\)
Cho bảng số liệu nhiệt động học chuẩn ở 298K:
Hợp chất
C₂H₅OH(l)
CO(g)
CO₂(g)
H₂O(l)
(kJ/mol)
-277,0
-110,5
-393,5
-285,8
S° (J/mol·K)
160,7
197,6
213,6
69,9
Tổng giá trị \(\Delta \mathrm{G}_{1}+\Delta \mathrm{G}_{2}\) của hai phản ứng trên là bao nhiêu ? Biết công thức tính \(\Delta \mathrm{G}=\Delta \mathrm{H}-\mathrm{T} \Delta \mathrm{S}(\mathrm{kJ} / \mathrm{mol})\) (làm tròn đến số nguyên )
Năm 2024, các nhà khoa học Trung Quốc đã thiết kế hệ thống để thu giữ khí \(\mathrm{CO}_{2}\) và sản xuất khí \(\mathrm{H}_{2}\), hệ thống này được minh họa trong hình dưới đây:
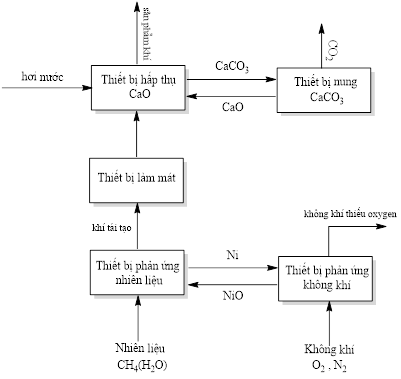
Cho các phát biểu sau:
“Năng lượng liên kết là năng lượng cần thiết để ..(1)... một liên kết hóa học trong phân tử ở thể ..(2)... thành nguyên tử ở thể khí.” Từ/cụm từ thích hợp để điền vào (1) và (2) lần lượt là
Quá trình hình thành nitrogen dioxide gồm 2 bước:
Bước 1: \(\mathrm{N}_{2}+\mathrm{O}_{2} \rightarrow 2 \mathrm{NO}\)
Bước 2: \(2 \mathrm{NO}+\mathrm{O}_{2} \rightarrow 2 \mathrm{NO}_{2}\)
Phản ứng tổng thể: \(\mathrm{N}_{2}+2 \mathrm{O}_{2} \rightarrow 2 \mathrm{NO}_{2}\)
Biết biến thiên enthalpy của phản ứng tổng thể là \(+68 \mathrm{kJ} / \mathrm{mol}\).
Vôi sống có nhiều ứng dụng như: sản xuất vật liệu xây dựng, vật liệu chịu nhiệt, khử chua đất trồng, tẩy uế, sát trùng, xử lí nước thải,. Hiện nay, nhiều lò nung vôi thủ công hoạt động tự phát, gây ảnh hưởng xấu đến môi trường xung quanh. Ở các lò nung vôi công nghiệp, quá trình kiểm soát phát thải ô nhiễm được thực hiện chặt chẽ hơn. Xét một lò nung với công nghiệp sử dụng than đá làm nhiên liệu. Giả thiết:
- Đá vôi chỉ chứa \(\mathrm{CaCO}_{3}\) và để phân hủy 1 kg đá vôi cần cung cấp một nhiệt lượng là 1800 KJ .
- Đốt cháy 1 kg than đá giải phóng ra một nhiệt lượng là 27000 KJ và có \(50 \%\) lượng nhiệt này được hấp thụ ở quá trình phân hủy đá vôi.
- Than đá chứa \(1 \%\) sulfur (ở dạng vô cơ và hữu cơ như \(\mathrm{FeS}_{2}, \mathrm{CaSO}_{4}, \mathrm{C}_{\mathrm{X}} \mathrm{HySH} .\). .) về khối lượng, \(80 \%\) lượng sulfur bị đốt cháy tạo thành \(\mathrm{SO}_{2}\) và \(1,6 \%\) lượng \(\mathrm{SO}_{2}\) sinh ra phát thải vào khí quyển.
- Công suất của lò nung vôi là 420 tấn vôi sống/ngày.
Tính entanpy tạo thành \(\left(\Delta_{\mathrm{f}} \mathrm{H}_{298}^{\rho}\right)\) của acetaldehyde \(\left(\mathrm{CH}_{3} \mathrm{CHO}\right)\) : Cho các dữ kiện như sau:
\(\mathrm{H}_{2(\mathrm{~g})}+\frac{1}{2} \mathrm{O}_{2(\mathrm{~g})} \longrightarrow \mathrm{H}_{2} \mathrm{O}_{(\mathrm{l})} \quad \Delta_{\mathrm{f}} \mathrm{H}_{298}^{\rho}=-286 \mathrm{~kJ} / \mathrm{mol} \tag{1}\)
\(\mathrm{C}(\mathrm{s})+\mathrm{O}_{2(\mathrm{~g})} \longrightarrow \mathrm{CO}_{2}(\mathrm{~g}) \quad \Delta_{\mathrm{f}} \mathrm{H}_{298}^{\rho}=-394 \mathrm{~kJ} / \mathrm{mol} \tag{2}\)
\(2 \mathrm{CH}_{3} \mathrm{CHO}_{(\mathrm{g})}+5 \mathrm{O}_{2(\mathrm{~g})} \longrightarrow 4 \mathrm{H}_{2} \mathrm{O}_{(\mathrm{l})}+4 \mathrm{CO}_{2(\mathrm{~g})} \quad \Delta_{\mathrm{r}} \mathrm{H}_{298}^{\rho_{2}}=-2388 \mathrm{~kJ} / \mathrm{mol} \tag{3}\)
Nhiệt nhôm là phản ứng giữa nhôm và oxide sắt \(\left(\mathrm{Fe}_{2} \mathrm{O}_{3}\right)\) nhằm tách sắt nguyên chất ra khỏi quặng. Phản ứng này tạo ra một lượng nhiệt rất lớn.
\(2 \mathrm{Al}(\mathrm{s})+\mathrm{Fe}_{2} \mathrm{O}_{3}(\mathrm{s}) \rightarrow \mathrm{Al}_{2} \mathrm{O}_{3}(\mathrm{s})+2 \mathrm{Fe}(\mathrm{s})\)
Biết nhiệt tạo thành của \(\mathrm{Fe}_{2} \mathrm{O}_{3}\) và \(\mathrm{Al}_{2} \mathrm{O}_{3}\) lần lượt là \(-824,2 \mathrm{kJ} / \mathrm{mol}\) và \(-1675,7 \mathrm{kJ} / \mathrm{mol}\). Giá trị biến thiên enthalpy của phản ứng nhiệt nhôm là
Quá trình nào sau đây là phản ứng thu nhiệt?
Freon-12 \(\left(\mathrm{CCl}_{2} \mathrm{F}_{2}\right)\) là một hợp chất thuộc nhóm CFC , được sử dụng rộng rãi làm chất làm lạnh. Tuy nhiên, việc sử dụng Freon-12 ngày càng bị hạn chế do khi thoát ra khí quyển, nó gây phá hủy tầng ozone. Phản ứng tổng hợp Freon-12 diễn ra theo phương trình:
\(\mathrm{CH}_{4}(\mathrm{g})+2 \mathrm{Cl}_{2}(\mathrm{g})+2 \mathrm{F}_{2}(\mathrm{g}) \rightarrow \mathrm{CF}_{2} \mathrm{Cl}_{2}(\mathrm{g})+2 \mathrm{HF}(\mathrm{g})+2 \mathrm{HCl}(\mathrm{g})(*)\)
Cho biết:
Liên kết
C-H
Cl-Cl
F-F
C-F
C-Cl
H-F
H-Cl
Eb (kJ/mol)
413
239
154
485
339
565
427
\(\Delta_{\mathrm{r}} \mathrm{H}_{298}{ }^{0}\) của phản ứng \((*)\) đã cho là
Xét phản ứng sau:
\(\mathrm{SO}_{2}(\mathrm{g})+\mathrm{O}_{2}(\mathrm{g}) \rightarrow \mathrm{SO}_{3}(\mathrm{l})\)
Biết nhiệt tạo thành của \(\mathrm{SO}_{2}(\mathrm{g})\) là \(-296,8 \mathrm{kJ} / \mathrm{mol}^{2}\) và \(\mathrm{SO}_{3}(\mathrm{l})\) là \(-441,0 \mathrm{kJ} / \mathrm{mol}\). Tính biến thiên enthalpy của phản ứng ở điều kiện chuẩn (theo \(\mathrm{kJ} / \mathrm{mol}\), làm tròn kết quả đến chũ số hàng đơn vị).
Nescafe đã sản xuất thành công lon coffee tự làm nóng. Để làm nóng coffee, chỉ cần ấn nút (trên lon) để trộn nguyên liệu gồm dung dịch KOH hoặc NaOH rất loãng và \(\mathrm{CaO} ; 210 \mathrm{mL}\) coffee trong lon sẽ được hâm nóng đến khoảng \(40^{\circ} \mathrm{C}\). Giả sử nhiệt dung riêng của coffee là \(4,18 \mathrm{J} / \mathrm{g} . \mathrm{K}\) (Nhiệt dung riêng là nhiệt lượng cần cung cấp để 1 gam chất tăng lên \(\left.1^{\circ} \mathrm{C}\right)\). Cho \(\Delta_{\mathrm{f}} \mathrm{H}_{298}^{0}\left(\mathrm{kJ.mol}^{-1}\right)\) của \(\mathrm{CaO}, \mathrm{H}_{2} \mathrm{O}_{(l)}, \mathrm{Ca}(\mathrm{OH})_{2}\) lần lượt là \(-635 ;-286\); -985 ; các giá trị này không đổi trong khoảng nhiệt độ đang xét. Nhiệt tỏa ra từ phản ứng thất thoát vào sản phẩm, vỏ hộp và môi trường là \(20 \%\).
Tính khối lượng CaO cần cung cấp để làm nóng 210 mL coffee từ \(10^{\circ} \mathrm{C}\) đến \(40^{\circ} \mathrm{C}(\mathrm{d}=1,0 \mathrm{g} / \mathrm{ml})\). (làm tròn đến phần nguyên).
Cho vòng tròn năng lượng như sau:
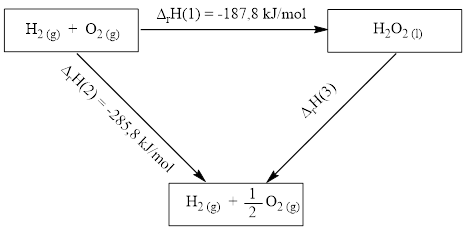
Tính giá trị của \(\Delta_{\mathrm{r}} \mathrm{H}(3)\)?
Cho sơ đồ mô tả enthalpy sau:
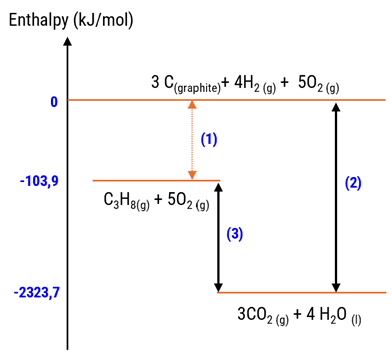
Cho các phát biểu sau:















