Để tăng hiệu quả tẩy trắng của bột giặt người ta thường cho thêm vào một ít bột sodium peroxide \(\left(\mathrm{Na}_{2} \mathrm{O}_{2}\right)\), vì sodium peroxide khi tác dụng với nước sẽ sinh ra \(\mathrm{H}_{2} \mathrm{O}_{2}\) là một chất oxi hóa mạnh có thể tẩy trắng được quần áo. Cách nào sau đây là cách tốt nhất để bảo quản bột giặt?
Để nơi râm mát, khô thoáng, đậy kín nắp.
Để nơi khô thoáng, không có nắp đậy.
Để nơi khô thoáng, có ánh sáng mặt trời.
Để nơi mát mẻ, có hơi ẩm.
Hãy suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Phản ứng hoá học xảy ra khi sodium peroxide tiếp xúc với nước và ánh sáng mặt trời
\(\begin{aligned} & \mathrm{Na}_{2} \mathrm{O}_{2}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow 2 \mathrm{NaOH}+\mathrm{H}_{2} \mathrm{O}_{2} \\ & 2 \mathrm{H}_{2} \mathrm{O}_{2} \rightarrow 2 \mathrm{H}_{2} \mathrm{O}+\mathrm{O}_{2}\end{aligned}\)
Đó là lý do không để bột giặt nơi có hơi ẩm và ánh sáng mặt trời.
Tuyển Tập Đề Thi Tham Khảo Tốt Nghiệp THPT Năm 2025 – Hóa Học – Bộ Đề 02 là tài liệu ôn tập quan trọng dành cho học sinh lớp 12, giúp các em rèn luyện kỹ năng làm bài và chuẩn bị tốt nhất cho kỳ thi tốt nghiệp THPT 2025. Bộ đề được biên soạn theo định hướng của Bộ GD ĐT, bám sát chương trình học, bao gồm các chủ đề trọng tâm như phản ứng oxi hóa - khử, điện hóa học, este – chất béo, amino axit – protein, kim loại và phi kim… Hệ thống câu hỏi trắc nghiệm đa dạng, được thiết kế theo nhiều mức độ từ nhận biết, thông hiểu đến vận dụng và vận dụng cao, giúp học sinh làm quen với cấu trúc đề thi và phát triển tư duy hóa học. Mỗi đề thi đều có đáp án chi tiết và hướng dẫn giải cụ thể, hỗ trợ học sinh tự đánh giá năng lực, xác định điểm mạnh và cải thiện điểm yếu trong quá trình ôn tập.
Câu hỏi liên quan
Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 \(\mathrm{mg} / \mathrm{L}\) (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật).
Phương pháp chuẩn độ iodine-thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: \(\mathrm{Cl}_{2}+2 \mathrm{KI} \longrightarrow \mathrm{KCl}+\mathrm{I}_{2}\).
Lượng \(\mathrm{I}_{2}\) sau đó được được nhận biết bằng hồ tinh bột, \(\mathrm{I}_{2}\) bị khử bởi dung dịch chuẩn sodium thiosul \(\mathfrak{f}\) ate theo phương trình: \(\mathrm{I}_{2}+2 \mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3} \longrightarrow 2 \mathrm{NaI}+\mathrm{Na}_{2} \mathrm{~S}_{4} \mathrm{O}_{6}\).
Dựa vào thể tích dung dịch \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) đã phản ứng, tính được dư lượng chlorine trong dung dịch mẫu. Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) 0,01 M thì thể tích \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) đã dùng trong lần chuẩn độ lần lượt như sau:
(dụng cụ chứa dung dịch chuẩn \(\mathrm{Na}_{2} \mathrm{~S}_{2} \mathrm{O}_{3}\) là loại buret 25 mL , vạch chia \(0,1 \mathrm{~mL}\) ). Tính lượng \(\mathrm{Cl}_{2}\) trong mẫu sản phẩm trên.
Sự cố tràn dầu thường xảy ra trong các hoạt động tìm kiếm, thăm dò, khai thác, vận chuyển, chế biến, phân phối và tàng trữ dầu khí và các sản phẩm của chúng. Ví dụ: các hiện tượng rò rỉ, phụt dầu, vỡ đường ống, vỡ bể chứa, tai nạn đâm và gây thủng tàu, sự cố tại các khoan dầu khí, nhà máy lọc hóa dầu ….
Ở Hình 9.6, Hình 9.7 và Hình 9.8 là các cách xử lý do sự cố tràn dầu. Hiện nay các nước sử dụng giải pháp nào có hiệu quả để hạn chế sự lan ra xung quanh của dầu khi xảy ra sự cố tràn dầu trên mặt biển?
Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa - khử như sau:
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây là sai?
Theo lý thuyết công thức của quặng pyrite là \(\mathrm{FeS}_{2}\). Thực tế một phân ion disulfide \(\mathrm{S}_{2}{ }^{-}\)bị thay thế bởi ion sulfide \(\left(\mathrm{S}^{2-}\right)\) nên coi pyrite như một hỗn hợp của \(\mathrm{FeS}_{2}\) và FeS. Như vậy, công thức tổng quát của pyrite có thể biểu diễn là \(\mathrm{FeS}_{\mathrm{x}}\) ). Khi xử lí m gam một mẫu pyrite (chỉ gồm \(\mathrm{FeS}_{2}\) và FeS ) bằng bromine trong dung dịch KOH dư người ta thu được kết tủa nâu đỏ A và dung dịch B. Nung kết tủa A đến khối lượng không đổi thu được 0,4 gam chất rắn. Thêm lượng dư dung dịch \(\mathrm{BaCl}_{2}\) vào dung dịch B thì thu được 2,2174 gam kết tủa trắng không tan trong acid. Xác định giá trị x trong công thức tổng quát \(\mathrm{FeS}_{\mathrm{x}}\) của quặng pyrite.
Theo QCVN 01-1:2018/BYT, hàm lượng manganese (Mn) tối đa cho phép trong nước sinh hoạt không được vượt quá \(0,3 \mathrm{mg} / \mathrm{L}\). Một mẫu nước chứa \(\mathrm{Mn}^{2+}\) với nồng độ chưa xác định. Để đánh giá hàm lượng manganese trong \(5 \mathrm{m}^{3}\) mẫu nước trên, người ta tiến hành tách loại manganese bằng cách sử dụng 50 gam \(\mathrm{KMnO}_{4}\) để oxy hóa toàn bộ \(\mathrm{Mn}^{2+}\) thành \(\mathrm{MnO}_{2}\) kết tủa theo phản ứng:
\(3 \mathrm{Mn}^{2+}+2 \mathrm{MnO}_{4}^{-}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow 5 \mathrm{MnO}_{2}+4 \mathrm{H}^{+}\)
Biết rằng phản ứng xảy ra hoàn toàn và toàn bộ \(\mathrm{MnO}_{2}\) được loại bỏ. Hàm lượng manganese trong mẫu nước này cao gấp bao nhiêu lần so với ngưỡng cho phép? (Làm tròn kết quả đến hàng đơn vị)
Một viên thực phẩm chức năng có khối lượng 250 mg trước nguyên tố sắt ở dạng muối Fe (II) cùng một số chất khác. Kết quả kiểm nghiệm thấy lượng Fe(II) trong viên này phản ứng vừa đủ với 8,5 mL dung dịch \(\mathrm{KMnO}_{4} 0,04 \mathrm{M}\). Phần trăm khối lượng của nguyên tố sắt trong viên thực phẩm chức năng trên là bao nhiêu? (Làm tròn kết quả đến hàng phần muời).
Xét phản ứng sau:
\(\mathrm{Fe}_{2} \mathrm{O}_{3}+3 \mathrm{CO} \rightarrow 2 \mathrm{Fe}+3 \mathrm{CO}_{2}\)
Phương trình biểu diễn quá trình khử của phản ứng trên là
Hòa tan 4,875 gam kim loại M (có hóa trị 2) trong HNO3 loãng, dư thì thu được 0,05 mol NO (sản phẩm khử duy nhất). Kim loại M là
Khi xảy ra phản ứng hóa học, lượng chất đầu biến đổi như thế nào?
Potassium dichromate \(\left(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\right)\) có thể được sử dụng để phát hiện nồng độ còn trong hơi thở. Phương trình phản ứng của alcohol và \(\mathrm{K}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\) như sau:
\(3 \mathrm{CH}_{3} \mathrm{CH}_{2} \mathrm{OH}+2 \mathrm{Cr}_{2} \mathrm{O}_{7}{ }^{2-}+16 \mathrm{H}^{+} \longrightarrow 3 \mathrm{CH}_{3} \mathrm{COOH}+4 \mathrm{Cr}^{3+}+11 \mathrm{H}_{2} \mathrm{O}\)
Sau phản ứng, màu sắc chuyển từ cam sang xanh lục, dữ liệu đo được bằng thiết bị có thể chuyển đổi thành nồng độ cồn. Ở nhiệt độ và áp suất bình thường, tỷ lệ nồng độ cồn trong máu ( \(\mathrm{mg} / \mathrm{L}\) ) so với nồng độ cồn trong hơi thở \((\mathrm{mg} / \mathrm{L})\) hiện đang là 2100 : 1. Theo luật quy định, nồng độ cồn trong mỗi lít hơi thở không được vượt quá \(0,25 \mathrm{mg}\). Cho đồ thị thể hiện mối quan hệ giữa nồng độ cồn trong hơi thở và chỉ số đo bằng thiết bị như sau:
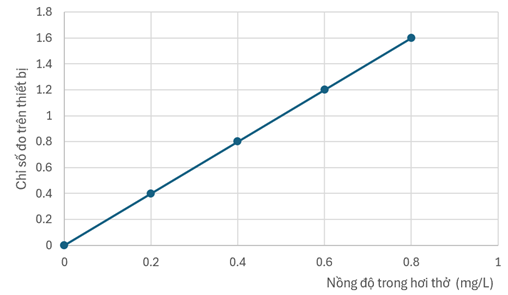
Khi chỉ số của thiết bị đo hơi thở của một người là 0,80 thì nồng độ cồn trong máu ( \(\mathrm{mmol} / \mathrm{L}\) ) của người đó là bao nhiêu? (làm tròn đáp án đến hàng đơn vị).
Trước đây, tinh thể copper(II) sulfate được "nuôi" như sau:
Bước 1: Cho dung dịch sulfuric acid loãng vào cốc thuỷ tinh.
Bước 2: Đun nóng dung dịch acid.
Bước 3: Thêm copper (II) oxide vào đến dư.
Bước 4: Đợi phản ứng xảy ra hoàn toàn rồi lọc hỗn hợp thu được.
Bước 5: Làm bay hơi nước lọc cho đến khi tinh thể xuất hiện trong cốc.
Bước 6: Làm mát cốc nước lọc.
Cho các phát biểu sau:
Nổ bụi là vụ nổ gây ra bởi quá trình bốc cháy nhanh của các hạt bụi mịn phân tán trong không khí bên trong một không gian hạn chế, tạo ra sóng nổ. Nổ bụi xảy ra khi có đủ năm yếu tố: nguồn oxygen, nguồn nhiệt, nhiên liệu (bụi có thể cháy được), nồng độ bụi mịn đủ lớn và không gian đủ kín. Năm 2007, một vụ nổ bụi xảy ra khi các công nhân hàn bảo trì bể chứa bột mì tại phân xưởng sản xuất bột mì ở tỉnh Bình Dương khiến 5 công nhân bị bỏng nặng.
Cho các phát biểu sau:
(a) Nổ bụi là một vụ nổ vật lí.
(b) Vụ nổ bụi xảy ra khi có đủ các yếu tố nguồn oxygen, nguồn nhiệt, không gian đủ kín.
(c) Nhiên liệu trong vụ nổ bụi tại phân xưởng bột mì ở Bình Dương là bụi bột mì.
(d) Bụi càng mịn khả năng gây nổ càng cao do phát tán nhanh và dễ lơ lửng trong không khí.
Số phát biểu sai là
Nối dung dịch sodium chloride với nguồn điện và một bóng đèn nhỏ. Quan sát thấy bóng đèn
Để xác định hàm lượng muối \(\mathrm{Fe}(\mathrm{II})\) trong 1 mẫu dung dịch A có thể dùng dung dịch thuốc tím \(\mathrm{KMnO}_{4}\), phương trình ion như sau:
\( \mathrm{MnO}_{4}^{-}+5 \mathrm{Fe}^{2+}+8 \mathrm{H}^{+} \longrightarrow \mathrm{Mn}^{2+}+5 \mathrm{Fe}^{3+}+4 \mathrm{H}_{2} \mathrm{O} \)
+ Người ta lấy \(25,00 \mathrm{mL}\) dung dịch A cho vào bình định mức, thêm nước cất cho đủ 100 mL , dung dịch thu được gọi là dung dịch X .
+ Lấy \(10,00 \mathrm{mL}\) từ dung dịch X chuyển vào bình tam giác. Thêm khoảng 5 mL dung dịch \(\mathrm{H}_{2} \mathrm{SO}_{4} 2 \mathrm{M}\).
+ Tiến hành chuẩn độ 3 lần bằng dung dịch \(\mathrm{KMnO}_{4} 0,02 \mathrm{M}\).
Kết quả thể tích \(\mathrm{KMnO}_{4}\) sau 3 lần chuẩn độ lần lượt là \(20,50 \mathrm{mL} ; 20,55 \mathrm{mL} ; 20,55 \mathrm{mL}\). Tính hàm lượng muối \(\mathrm{Fe}^{2+}(\mathrm{g} / \mathrm{L})\) trong dung dịch A (làm tròn đáp án đến hàng phần mười)
Trong phòng thí nghiệm, một học sinh nhúng thanh Cu có khối lượng 12,340 gam vào 256 mL dung dịch \(\mathrm{AgNO}_{3} 0,125 \mathrm{M}\). Sau một thời gian, lấy thanh Cu đem sấy khô và cân lại có khối lượng 12,492 gam. Khối lượng Ag sinh ra là bao nhiêu, nếu giả thiết rằng toàn bộ lượng Ag giải phóng đều bám vào thanh đồng.
Trong hợp chất \(\mathrm{Na}_{2} \mathrm{SO}_{4}\), số oxi hóa của sulfur là
Cho các cặp oxi hóa - khử và giá trị thế điện cực chuẩn tương ứng sau:
Cặp oxi hóa khử
X2+/X
Y2+/Y
Z2+/Z
T2+/T
E+/E
Thế điện cực chuẩn (V)
0,340
-2,356
-0,440
0,854
0,799
Dãy sắp xếp các ion theo thứ tự tính oxi hóa tăng dần là
Tất cả các huy chương Olympics London 2012 đều có đường kính 85 mm và độ dày 7 mm . Các huy chương Đồng được làm bằng hợp kim chứa copper. Tiến hành quy trình phân tích định lượng sau để xác định thành phần hợp kim: Hòa \(\tan 0,800 \mathrm{~g}\) mẫu huy chương Đồng vào dung dịch nitric acid đậm đặc, nóng. Sau khi làm nguội và pha loãng, thêm một lượng dư dung dịch potassium iodide vào rồi tiếp tục pha loãng dung dịch đến \(250,0 \mathrm{~cm}^{3}\). Biết \(25,00 \mathrm{~cm}^{3}\) mẫu dung dịch này phản ứng vừa đủ với \(12,20 \mathrm{~cm}^{3}\) dung dịch sodium thiosulfate \(0,100 \mathrm{M}\).
Cho các phương trình xảy ra như sau:
Tính hàm lượng đồng trong chiếc huy chương đồng.
Nồng độ ion \(\mathrm{NO}_{3}{ }^{-}\)trong nước uống tối đa cho phép là 9 ppm (part per million - phần triệu). Nếu thừa ion này sẽ gây ra một loại bệnh thiếu máu hoặc tạo thành nitrosamin (một hợp chất gây ung thư đường tiêu hóa). Để xác định hàm lượng ion \(\mathrm{NO}_{3}{ }^{-}\)trong 200 mL nước người ta dùng các hoá chất ( \(\mathrm{Cu}+\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng) thấy cần dùng đến \(1,92 \mathrm{mg} \mathrm{Cu}\). Hàm lượng \(\mathrm{NO}_{3}{ }^{-}\)trong mẫu nước trên là bao nhiêu?
Khi vắt chanh vào mắm tôm và dùng đũa đánh mắm tôm thì thấy có hiện tượng sủi bọt là do















