10 Đề thi kiểm tra cuối HK1 môn Vật lí lớp 12 - CTST - Đề 6
28 câu hỏi 60 phút
Từ hình ảnh về quỹ đạo chuyển động Brown của hạt khói trong không khí dưới đây, có thể thấy các phân tử khí chuyển động

hỗn loạn, không liên tục
có trật tự, liên tục
hỗn loạn, không ngừng
không liên tục
Từ hình ảnh về quỹ đạo chuyển động Brown của hạt khói trong không khí dưới đây, có thể thấy các phân tử khí chuyển động hỗn loạn, không ngừng.
Danh sách câu hỏi:
Từ hình ảnh về quỹ đạo chuyển động Brown của hạt khói trong không khí dưới đây, có thể thấy các phân tử khí chuyển động hỗn loạn, không ngừng.
Một mẫu vật chất có khối lượng m, chứa N phân tử thì số mol n của mẫu vật đó được xác định theo biểu thức sau:
\(\mathrm{n}=\frac{\mathrm{N}}{\mathrm{~N}_{\mathrm{A}}}=\frac{\mathrm{m}}{\mathrm{M}}\)
Câu 3:
Các thông số trạng thái của một lượng khí không bao gồm đại lượng nào dưới đây của lượng khí đó?
Các thông số trạng thái của một lượng khí gồm: thể tích, nhiệt độ và áp suất của lượng khí đó.
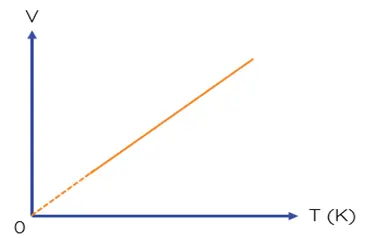
Trong hệ tọa độ (V, T), đường đẳng áp là đường thẳng kéo dài đi qua gốc tọa độ.
Phương trình trạng thái của khí lí tưởng: \(\frac{\mathrm{p}_1 \mathrm{V}_1}{\mathrm{~T}_1}=\frac{\mathrm{p}_2 \mathrm{V}_2}{\mathrm{~T}_2}\) hay \(\frac{\mathrm{pV}}{\mathrm{~T}}\) = hằng số \(\Rightarrow\) pV ~ T.
Câu 19:
Mô hình động học phân tử chất khí đã thuyết phục được nhiều nhà vật lí về sự tồn tại của các phân tử trước khi người ta có thể quan sát được chúng
Chất khí được cấu tạo từ các phân tử có kích thước rất lớn so với khoảng cách giữa chúng
Lực liên kết giữa các phân tử ở thể khí rất yếu so với ở thể lỏng và thể rắn
Các phân tử khí chuyển động hỗn loạn, không ngừng
Các phân tử khí không thể gây áp suất lên thành bình
Câu 20:
Định luật Boyle được nhà vật lí và hóa học người Ireland là Robert Boyle (1627 - 1691) tìm ra bằng thực nghiệm năm 1662 khi ông nghiên cứu về quá trình biến đổi trạng thái của một khối lượng khí xác định
Quá trình đẳng nhiệt là quá trình biến đổi trạng thái của một khối lượng khí xác định khi nhiệt độ giữ không đổi
Định luật Boyle phù hợp với quá trình đẳng nhiệt
Khi nhiệt độ của một khối lượng khí xác định giữ không đổi thì áp suất gây ra bởi khí tỉ lệ thuận với thể tích của nó
Đồ thị biểu diễn định luật Boyle là một nhánh của đường parabol
Câu 21:
Một lượng khí lí tưởng được đựng trong một xi lanh có pit-tông chuyển động được. Áp suất của khí là 0,7 atm và nhiệt độ là 47oC
Với khí lí tưởng, va chạm giữa các phân tử khí là va chạm mềm
Thể tích của khí trong xi lanh là không đổi trong mọi quá trình biến đổi trạng thái
Khi áp suất trong xi lanh tăng đến 8 atm còn thể tích khí trong xi lanh giảm 5 lần thì nhiệt độ khí là 731,4 K
Khi giữ pit-tông cố định, tăng nhiệt độ khí trong xi lanh tới 273oC thì áp suất khí trong xi lanh là 1,19 atm
Câu 22:
Một bình đựng một khối lượng khí. Cho hằng số Boltzmann k = 1,38.10-23 J/K
Động năng trung bình của các phân tử khí chỉ phụ thuộc vào nhiệt độ khối khí
Khi nhiệt độ khối khí tăng thì động năng của mỗi phân tử khí đều tăng
Động năng trung bình của mỗi phân tử khí ở 27oC là 24,84.10-23 J
Biết thành phần chính của không khí là N2 (khối lượng mol là 28) và O2 (khối lượng mol 32). Khi đó tốc độ bình phương trung bình (\(\overline{v^2}\)) của các phân tử N2 lớn hơn tốc độ bình phương trung bình của các phân tử O2