Magie hiđroxit có công thức hóa học là:
Bộ Đề Thi Thử Tốt nghiệp THPT môn Hóa học năm 2025 - Đề thi thử Tốt nghiệp THPT môn Hóa học năm 2023
Đề thi thử Tốt nghiệp THPT môn Hóa học năm 2025 không chỉ giúp học sinh củng cố kiến thức đã học mà còn rèn luyện khả năng tư duy logic và giải quyết vấn đề nhanh chóng, chính xác. Đề thi bao gồm các dạng bài tập đa dạng để các em chuẩn bị tốt cho kỳ thi khác.
Câu hỏi liên quan
Nung 400 gam quặng dolomite có chứa \(92 \%\left(\mathrm{MgCO}_{3}. \mathrm{CaCO}_{3}\right)\) về khối lượng, còn lại là tạp chất rắn trơ, không bị phân hủy (coi như phản ứng xảy ra hoàn toàn). Sau phản ứng thu được chất rắn X và khí \(\mathrm{CO}_{2}\). Phần trăm khối lượng của calcium có trong chất rắn X là
Độ tan trong nước của \(\mathrm{Ba}\left(\mathrm{NO}_{3}\right)_{2}\) ở \(10^{\circ} \mathrm{C}\) và \(20^{\circ} \mathrm{C}\) lần lượt là \(6,67 \mathrm{g} / 100 \mathrm{g}\) nước và \(9,02 \mathrm{g} / 100 \mathrm{g}\) nước. Khi đưa 109,02 gam dung dịch \(\mathrm{Ba}\left(\mathrm{NO}_{3}\right)_{2}\) bão hòa \({ }^{\circ} 20^{\circ} \mathrm{C}\) về \(10^{\circ} \mathrm{C}\) thì thu được bao nhiêu gam tinh thể \(\mathrm{Ba}\left(\mathrm{NO}_{3}\right)_{2} \cdot 6 \mathrm{H}_{2} \mathrm{O}\)?
Để khám phá tính chất của Cu, người ta tiến hành thì nghiệm sau đây:
Thí nghiệm 1: Lấy một lượng bột đồng thích hợp cho vào ống nghiệm chứa dung dịch \(\mathrm{FeCl}_{3}\) màu vàng nâu \(0,1 \mathrm{M}\). Sau khi phản ứng xảy ra, dung dịch chuyển sang màu xanh, cho thấy \(\mathrm{CuCl}_{2}\) được tạo thành. Sau 2 ngày, dung dịch chuyển sang màu xanh nhạt và xuất hiện kết tủa màu trắng. Sau khi kiểm tra, thấy kết tủa màu trắng là CuCl.
Thí nghiệm 2: Cho dung dịch màu xanh lam trong suốt ở thí nghiệm 1 vào ống nghiệm, nhỏ dung dịch KSCN \(0,10 \mathrm{M}\) vào ống nghiệm, dung dịch lập tức chuyển sang màu đỏ và xuất hiện kết tủa màu trắng. Lắc ống nghiệm, màu đỏ dần mất đi và kết tủa trắng tăng lên. Sau khi thử nghiệm, người ta phát hiện kết tủa màu trắng đó chính là CuSCN.
Thí nghiệm 3: Nhỏ dung dịch \(\mathrm{KSCN} 0,10 \mathrm{M}\) vào ống nghiệm chứa 2 mL dung dịch \(\mathrm{CuSO}_{4} 0,1 \mathrm{M}\), không thấy có kết tủa trắng xuất hiện.
Cho biết rằng CuCl và CuSCN đều là chất rắn màu trắng, ít tan trong nưởc. Cho các phát biểu sau:
Hòa tan hoàn toàn hai chất rắn \(\mathbf{X}, \mathbf{Y}\) (có số mol bằng nhau) vào nước thu được dung dịch \(\mathbf{Z}\). Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho dung dịch NaOH dư vào V mL dung dịch \(\mathbf{Z}\), thu được a mol kết tủa.
Thí nghiệm 2: Cho dung dịch \(\mathrm{NH}_{3}\) dư vào V mL dung dịch \(\mathbf{Z}\), thu được b mol kết tủa.
Thí nghiệm 3: Cho dung dịch \(\mathrm{AgNO}_{3}\) dư vào V mL dung dịch \(\mathbf{Z}\), thu được c mol kim loại.
Biết các phản ứng xảy ra hoàn toàn và \(\mathrm{a}<\mathrm{b}\) và \(\mathrm{X}, \mathrm{Y}\) chỉ có thể là muối chloride của các kim loại sau: Fe , \(\mathrm{Cu}, \mathrm{Al}\).
Cho các phát biểu sau:
Kim loại nào sau đây không tan trong dung dịch \(\mathrm{H}_{2} \mathrm{SO}_{4}\) đặc, nguội?
Cho sơ đồ sau: \(\mathrm{Fe} \xrightarrow{+\mathrm{Cl}_{2}, \mathrm{t}^{0}} \mathrm{~A} \xrightarrow{+\mathrm{KOH}} \mathrm{B} \xrightarrow{+\mathrm{t}^{0}} \mathrm{X}\) . Chất X là
Trong nước nguyên chất khi phản ứng xảy ra sẽ có quá trình sau:
\(2 \mathrm{H}_{2} \mathrm{O}+2 \mathrm{e} \rightarrow \mathrm{H}_{2}+\mathrm{OH}^{-} \quad \mathrm{E}_{2 \mathrm{H}_{2} \mathrm{O} / \mathrm{H}_{2}+2 \mathrm{OH}^{-}}^{0}=-0,413 \mathrm{V}.\)
Cho \(\mathrm{E}_{\mathrm{Na}^{+} / \mathrm{Na}}^{0}=-2,71 \mathrm{V} ; \mathrm{E}_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^{0}=+0,34 \mathrm{V} ; \mathrm{E}_{\mathrm{Mg}^{2+} / \mathrm{Mg}}^{0}=-2,36 \mathrm{V} ; \mathrm{E}_{\mathrm{Al}^{3+} / \mathrm{Al}}^{0}=-1,68 \mathrm{V}\).
Phát biểu nào sau đây là đúng?
Cho các dung dịch sau: \(\mathrm{HCl}, \mathrm{Na}_{2} \mathrm{CO}_{3}, \mathrm{AgNO}_{3}, \mathrm{Na}_{2} \mathrm{SO}_{4}, \mathrm{NaOH}\) và \(\mathrm{KHSO}_{4}\). Số dung dịch tác dụng được với dung dịch \(\mathrm{FeCl}_{2}\) là
Trong tự nhiên quặng bauxite có thành phần chính là \(\mathrm{Al}_{2} \mathrm{O}_{3}\). Quặng bauxite mỏ Tây Tân Rai - Lâm Đồng nói riêng và các mỏ thuộc vùng Tây nguyên của Việt Nam nói chung là loại quặng bauxite có nguồn gốc phong hóa từ các loại đá bazan, quặng thường có màu nâu sẫm, nâu đỏ, hoặc xám, xám phớt vàng.
Có thể dùng lượng dư dung dịch của chất nào sau đây để tách Ag ra khỏi hỗn hợp Ag, Fe, Cu mà vẫn giữ nguyên khối lượng Ag ban đầu?
Chuẩn độ \(\mathrm{V}_{1}\ \mathrm{mL}\) dung dịch chứa muối \(\mathrm{Fe}^{2+}\) nồng độ \(\mathrm{C}_{1}\ \mathrm{M}\) và dung dịch \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng, đựng trong bình tam giác bằng dung dịch \(\mathrm{KMnO}_{4}\) nồng độ \(\mathrm{C}_{2}(\mathrm{M})\) để ở burette. Khi vạch thể tích dung dịch dịch \(\mathrm{KMnO}_{4}\) trên burette là \(\mathrm{V}_{2}\ \mathrm{mL}\) thì trong bình tam giác xuất hiện màu hồng bền trong khoảng 20 giây.
Thêm từ từ dung dịch HCl 1M vào dung dịch chứa 5,25 gam hỗn hợp muối cacbonnat của 2 kim loại kiềm thuộc hai chu kì kế tiếp đến khi có 0,015 mol khí thoát ra thì dừng lại. Cho dung dịch thu được tác dụng với dung dịch Ca(OH)2 dư cho 3 gam kết tủa. Công thức của 2 muối và thể tích dung dịch HCl đã dùng là
Ở \(25^{\circ} \mathrm{C}\), độ tan của \(\mathrm{CaSO}_{4}\) trong nước là \(1,47 \cdot 10^{-2} \mathrm{M}\). Trộn 25 mL dung dịch \(\mathrm{Ca}\left(\mathrm{NO}_{3}\right)_{2} 0,10\) M với 25 mL dung dịch \(\mathrm{Na}_{2} \mathrm{SO}_{4} 0,10 \mathrm{M}\) thu được lượng nhỏ kết tủa và 50 mL dung dịch. Bỏ qua sự thủy phân của các ion. \(\%\) lượng \(\mathrm{Ca}^{2+}\) đã kết tủa là bao nhiêu?
Khi nung nóng, các muối ngậm nước sẽ mất dần khối lượng. Sự giảm khối lượng muối \(\mathrm{Al}\left(\mathrm{NO}_{3}\right)_{3}.9 \mathrm{H}_{2} \mathrm{O}\) theo nhiệt độ được biểu diễn bởi giản đồ sau:
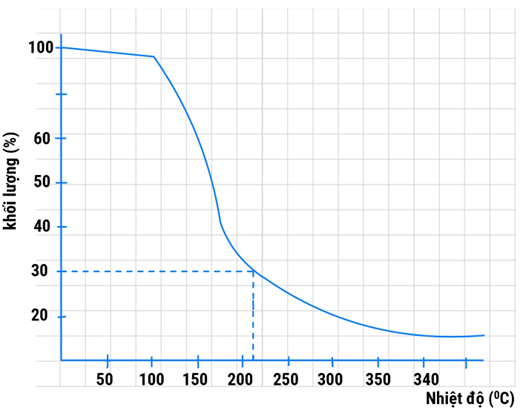
Biết rằng, khi tăng nhiệt độ, \(\mathrm{H}_{2} \mathrm{O}\) tách ra trước, sau đó đến phản ứng nhiệt phân muối khan. Tại nhiệt độ \(210^{\circ} \mathrm{C}\), phần rắn còn lại (chứa ba nguyên tố). Tính thành phần \% theo khối lượng của oxygen có trong phần chất rắn tại \(210^{\circ} \mathrm{C}\). (làm tròn đáp án đến hàng phần mười)
Cho 11,6 gam Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam hỗn hợp kim loại. Giá trị của m là
Chất nào sau đây tác dụng với dung dịch \(\mathrm{NaHCO}_{3}\) sinh ra khí \(\mathrm{CO}_{2}\)?
A là tinh thể muối chloride kép ngậm nước của Mg và một kim loại kiềm, được hình thành từ quá trình bốc hơi nước biển. Để xác định công thức của A , người ta tiến hành hai thí nghiệm sau:
Thí nghiệm 1: Hoà tan hết 1,110 gam A vào nước thu dung dịch B , cho B tác dụng với lượng dư dung dịch \(\mathrm{AgNO}_{3}\) thì thu được 1,722 gam kết tủa trắng.
Thí nghiệm 2: Nung 1,665 gam A đến khối lượng không đổi thu được chất rắn C có khối lượng giảm \(38,92 \%\) so với khối lượng A ban đầu. Cho C tác dụng với lượng dư dung dịch NaOH thu được kết tủa D. Lọc lấy kết tủa, rửa sạch rồi đem nung trong không khí đến khối lượng không đổi, thu được 0,24 gam chất rắn E (coi các phản ứng xảy ra hoàn toàn).
Tổng số nguyên tử có trong A là bao nhiêu?
Theo QCVN 01-1:2018/BYT, hàm lượng sắt tối đa cho phép trong nước sinh hoạt là \(0,3 \mathrm{mg} / \mathrm{L}\). Một mẫu nước có hàm lượng sắt tồn tại ở dạng \(\mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}\) và \(\mathrm{FeSO}_{4}\) với tỉ lệ mol tương ứng là \(1: 8\). Để đánh giá hàm lượng sắt trong mẫu nước trên người ta tiến hành tách loại sắt trong \(10 \mathrm{m}^{3}\) mẫu nước bằng cách sử dụng 122 gam vôi tôi (vừa đủ) để tăng pH , sau đó sục không khí:
\(\mathrm{Fe}_{2}\left(\mathrm{SO}_{4}\right)_{3}+\mathrm{Ca}(\mathrm{OH})_{2} \longrightarrow \mathrm{Fe}(\mathrm{OH})_{3}+\mathrm{CaSO}_{4}(1)\)
\(\mathrm{FeSO}_{4}+\mathrm{Ca}(\mathrm{OH})_{2}+\mathrm{O}_{2}+\mathrm{H}_{2} \mathrm{O} \longrightarrow \mathrm{Fe}(\mathrm{OH})_{3}+\mathrm{CaSO}_{4}(2)\)
Giả thiết vôi tôi chỉ chứa \(\mathrm{Ca}(\mathrm{OH})_{2}\). Hàm lượng sắt cao gấp bao nhiêu lần so với ngưỡng cho phép?
Chất nào sau đây có thể làm thuốc trừ sâu, thường dùng để phun trị bệnh nấm mốc sương cho nho?
Trộn bột kim loại \(X\) với bột iodine, thêm 1 vài giọt nước làm xúc tác thì phản ứng tỏa nhiệt mạnh, có khói màu tím bốc lên. X là kim loại nào sau đây?















