Dung dịch của NaCl trong nước nằm cân bằng với NaCl rắn ở áp suất không đổi (P = const). Số cấu tử và bậc tự do của hệ lần lượt là:
Đáp án đúng: B
Sưu tầm và chia sẻ hơn 850 câu trắc nghiệm môn Hóa học đại cương (kèm đáp án) dành cho các bạn sinh viên, sẽ giúp bạn hệ thống kiến thức chuẩn bị cho kì thi sắp diễn ra. Mời các bạn tham khảo!
Câu hỏi liên quan
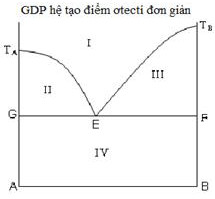
Phát biểu 1 sai: Tại điểm E, không thể thu được A hoặc B tinh khiết bằng cách điều chỉnh nhiệt độ. Điểm E là điểm mà tại đó pha lỏng chuyển trực tiếp thành hỗn hợp cơ học của A và B (hỗn tinh) hoặc ngược lại. Tức là, khi làm nguội chậm hợp kim có thành phần ứng với điểm E, nó sẽ kết tinh đồng thời ra cả A và B, tạo thành hỗn hợp eutecti.
Phát biểu 2 đúng: Tại điểm ơtecti, hệ là vô biến, tức là bậc tự do F = 0. Điều này có nghĩa là tại nhiệt độ và thành phần ơtecti, hệ không có khả năng thay đổi các thông số mà không làm thay đổi số pha của nó. Theo quy tắc pha Gibbs: F = C - P + n, với C là số cấu tử, P là số pha, và n là số yếu tố ảnh hưởng (thường là nhiệt độ và áp suất). Trong hệ hai cấu tử (C = 2) ở áp suất không đổi (n = 1), tại điểm ơtecti có ba pha (P = 3 - lỏng, A rắn, B rắn) cùng tồn tại, do đó F = 2 - 3 + 1 = 0.
Phát biểu 3 đúng: Quá trình nóng chảy hoặc đông đặc tại điểm E xảy ra ở nhiệt độ không đổi. Điều này là do nhiệt lượng tỏa ra khi kết tinh cân bằng với nhiệt lượng mất đi khi làm lạnh, giữ cho nhiệt độ hệ không đổi cho đến khi toàn bộ pha lỏng đã chuyển thành hỗn hợp rắn hoặc ngược lại.
Phát biểu 4 sai: Nhiệt độ tại điểm E là nhiệt độ thấp nhất mà tại đó hợp kim của hệ A-B có thể tồn tại ở trạng thái lỏng hoàn toàn. Các hỗn hợp khác sẽ bắt đầu kết tinh ở nhiệt độ cao hơn nhiệt độ ơtecti.
Vậy, các phát biểu đúng là 2 và 3.
Đầu tiên, ta cần xác định số mol của ZnI2 và H2O.
- Khối lượng mol của ZnI2 = 65,38 + 2 * 126,90 = 319,18 g/mol
- Trong 100 ml H2O có 432,0 g ZnI2.
- Số mol ZnI2 = 432,0 / 319,18 = 1,353 mol
- Khối lượng của 100 ml H2O (coi d = 1 g/ml) = 100 g
- Số mol H2O = 100 / 18 = 5,556 mol
- Tổng số mol = 1,353 + 5,556 = 6,909 mol
- Nồng độ phần mol của ZnI2 = 1,353 / 6,909 = 0,196
- Nồng độ phần mol của H2O = 5,556 / 6,909 = 0,804
Tuy nhiên, các đáp án không có cặp số này, có lẽ do sự làm tròn số. Để tìm đáp án gần đúng nhất, ta xét đáp án 2: 0,128 và 0,872.
Ta nhận thấy có một sự nhầm lẫn ở đây. Đề bài cho độ tan của ZnI2 là 432,0 g/100 ml H2O. Như vậy, 100 ml H2O tương ứng với 100g H2O, tương ứng với 100/18 = 5.556 mol H2O. Lượng ZnI2 tan vào là 432g, tương ứng 432/319.18 = 1.353 mol ZnI2. Tổng số mol là 5.556 + 1.353 = 6.909 mol. Vậy nồng độ mol của ZnI2 là 1.353/6.909 = 0.196 và nồng độ mol của H2O là 5.556/6.909 = 0.804. Các đáp án không có số này. Cần xem xét lại đề bài và dữ kiện.
Nếu độ tan là 432g ZnI2 trong 100g DUNG DỊCH, thì ta làm như sau:
m(H2O) = 100 - 43.2 = 56.8g
n(H2O) = 56.8/18 = 3.156 mol
n(ZnI2) = 43.2/319.18 = 0.135 mol
Tổng số mol = 3.156 + 0.135 = 3.291 mol
Phần mol ZnI2 = 0.135/3.291 = 0.041
Phần mol H2O = 3.156/3.291 = 0.959
Như vậy, không có đáp án nào đúng trong các đáp án đã cho. Có thể có lỗi trong đề bài hoặc các đáp án.

Bộ Đồ Án Tốt Nghiệp Ngành Trí Tuệ Nhân Tạo Và Học Máy

Bộ 120+ Đồ Án Tốt Nghiệp Ngành Hệ Thống Thông Tin

Bộ Đồ Án Tốt Nghiệp Ngành Mạng Máy Tính Và Truyền Thông

Bộ Luận Văn Tốt Nghiệp Ngành Kiểm Toán

Bộ 370+ Luận Văn Tốt Nghiệp Ngành Kế Toán Doanh Nghiệp

Bộ Luận Văn Tốt Nghiệp Ngành Quản Trị Thương Hiệu
ĐĂNG KÝ GÓI THI VIP
- Truy cập hơn 100K đề thi thử và chính thức các năm
- 2M câu hỏi theo các mức độ: Nhận biết – Thông hiểu – Vận dụng
- Học nhanh với 10K Flashcard Tiếng Anh theo bộ sách và chủ đề
- Đầy đủ: Mầm non – Phổ thông (K12) – Đại học – Người đi làm
- Tải toàn bộ tài liệu trên TaiLieu.VN
- Loại bỏ quảng cáo để tăng khả năng tập trung ôn luyện
- Tặng 15 ngày khi đăng ký gói 3 tháng, 30 ngày với gói 6 tháng và 60 ngày với gói 12 tháng.