Điện phân \(\mathrm{CaCl}_{2}\) nóng chảy, ở cathode xảy ra quá trình nào?
Tuyển Tập Đề Thi Tham Khảo Tốt Nghiệp THPT Năm 2025 – Hóa Học – Bộ Đề 02 là tài liệu ôn tập quan trọng dành cho học sinh lớp 12, giúp các em rèn luyện kỹ năng làm bài và chuẩn bị tốt nhất cho kỳ thi tốt nghiệp THPT 2025. Bộ đề được biên soạn theo định hướng của Bộ GD ĐT, bám sát chương trình học, bao gồm các chủ đề trọng tâm như phản ứng oxi hóa - khử, điện hóa học, este – chất béo, amino axit – protein, kim loại và phi kim… Hệ thống câu hỏi trắc nghiệm đa dạng, được thiết kế theo nhiều mức độ từ nhận biết, thông hiểu đến vận dụng và vận dụng cao, giúp học sinh làm quen với cấu trúc đề thi và phát triển tư duy hóa học. Mỗi đề thi đều có đáp án chi tiết và hướng dẫn giải cụ thể, hỗ trợ học sinh tự đánh giá năng lực, xác định điểm mạnh và cải thiện điểm yếu trong quá trình ôn tập.
Câu hỏi liên quan
Hai nhóm học sinh tiến hành thí nghiệm điện phân dung dịch \(\mathrm{CuSO}_{4}\) với một điện cực than chì và một điện cực bằng đồng (bỏ qua sự thay đổi thể tích của dung dịch khi điện phân).
Nhóm 1: Nối điện cực than chì với cực dương và điện cực đồng với cực âm của nguồn điện.
Nhóm 2: Nối điện cực than chì với cực âm và điện cực đồng với cực dương của nguồn điện.
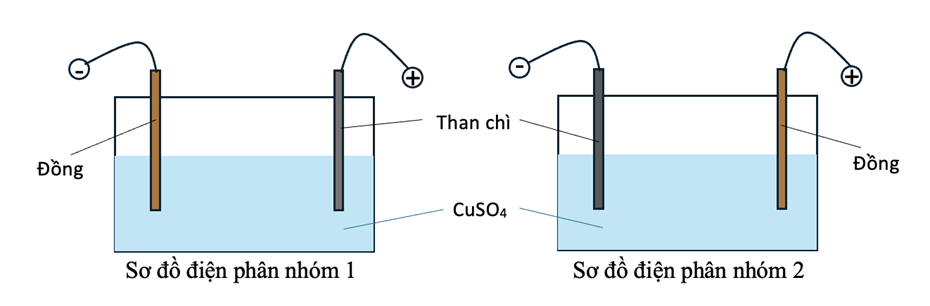
Hai nhóm đều đưa ra giả thuyết sau: trong quá trình điện phân, nồng độ ion \(\mathrm{Cu}^{2+}\) giảm dần ứng với màu xanh của dung dịch nhạt dần. Phát biểu nào sau đây là sai?
Một học sinh tiến hành thí nghiệm điện phân 100 mL dung dịch \(\mathrm{CuSO}_{4} 0,5 \mathrm{M}\), sử dụng bộ dụng cụ được mô tả như hình bên.
Cho biết trong thí nghiệm: hiệu điện thế được giữ cố định, đảm bảo nước không bị điện phân ở cả hai điện cực, bỏ qua sự bay hơi của nước trong quá trình điện phân.Cho các phát biểu sau:
Cho các cặp oxi hoá - khử và thế điện cực chuẩn tương ứng:
Cặp oxi hóa – khử
2H+/H2
Cu2+/Cu
Fe2+/Fe
Ag+/Ag
Thế điện cực chuẩn (V)
0,00
+0,34
-0,44
+0,799
Khi điện phân dung dịch chứa đồng thời bốn loại cation trên với nồng độ mol bằng nhau, cation bị điện phân đầu tiên ở cathode là
Điện phân dung dịch \(\mathrm{CuSO}_{4}\) với điện cực Pt. Theo thời gian, màu xanh của dung dịch \(\mathrm{CuSO}_{4}\) nhạt dần và mất hẳn đồng thời có khí thoát ra ở 2 điện cực. Khí thoát ra ở cathode và anode lần lượt là.
Tiến hành thí nghiệm như hình vẽ dưới đây:
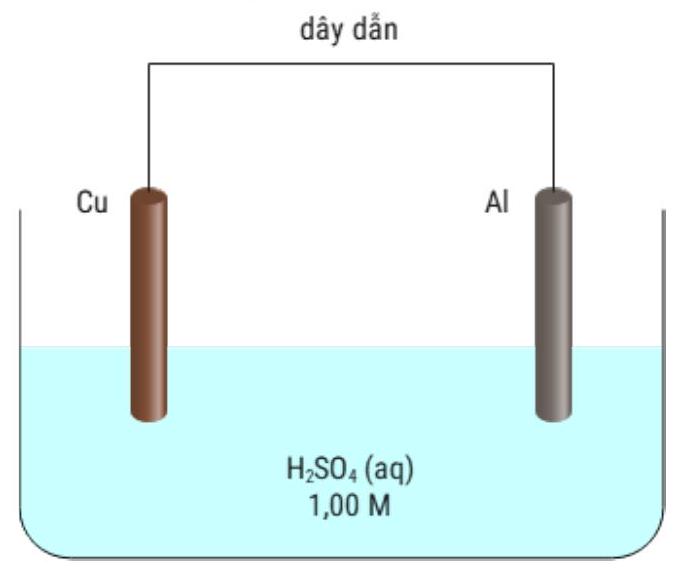 Phát biểu nào sau đây là SAI?
Phát biểu nào sau đây là SAI?. Một học sinh làm thí nghiệm: Điện phân dung dịch NaCl
- Lắp thiết bị thí nghiệm điện phân dung dịch NaCl với điện cực trơ như hình bên dưới.
- Rót khoảng 80 mL dung dịch NaCl bão hoà vào cốc rồi nhúng hai điện cực graphite vào dung dịch.
- Nối hai điện cực graphite với hai cực của nguồn điện và tiến hành điện phân trong khoảng 5 phút.
- Cho một mẫu cánh hoa màu hồng vào cốc chứa khoảng 5 mL dung dịch sau điện phân.
Quan sát hiện tượng thí nghiệm, học sinh có nhận xét:
Thí nghiệm điện phân dung dịch copper (II) sulfate với các điện cực trơ (graphite) được mô phỏng như hình vẽ sau đây:
Điện phân dung dịch NaCl bão hòa, không có màng ngăn để sản xuất hóa chất nào dưới đây?
Cho các phát biểu sau:
(a) Tráng Sn lên Fe là phương pháp bảo vệ kim loại bằng phương pháp điện hóa.
(b) Trong quá trình điện phân, tại anode xảy ra quá trình oxi hóa.
(c) Cho mẫu nhỏ Na vào dung dịch \(\mathrm{CuSO}_{4}\), thấy xuất hiện kết tủa màu đỏ.
(d) Vỏ các loài ốc, sò, hến có chứa \(\mathrm{CaCO}_{3}\).
(e) Để phân biệt khí \(\mathrm{CO}_{2}\) và \(\mathrm{SO}_{2}\) có thể dùng dung dịch nước vôi trong
Số phát biểu đúng là
Điện phân dung dịch \(\mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2}\) với điện cực trơ, ở anode xảy ra quá trình nào?
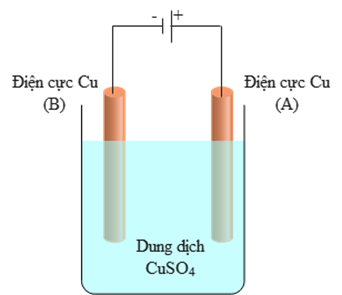
Một học sinh muốn xác định hàm lượng Cu có trong hợp \(\operatorname{kim} \mathrm{Cu}-\mathrm{Zn}\), học sinh đã tiến hành làm thí nghiệm như sau:
- Bước 1: Tiến hành cân thanh hợp kim Cu-Zn (2,25 gam) và thanh đồng nguyên chất (2,58 gam).
- Bước 2: Nối thanh hợp kim với cực dương, thanh đồng nguyên chất với cực âm của nguồn điện một chiều có hiệu điện thế phù hợp, rồi nhúng vào bình điện phân chứa dung dịch copper(II) sulfate.
Sau một thời gian điện phân, làm khô, rồi cân lại khối lượng thanh đồng nguyên chất (2,99 gam). Giả thuyết trong quá trình điện phân không chịu sự ảnh hưởng của các yếu tố khác như: hoạt độ của ion và quá thế, \(\ldots\). Học sinh đã phát biểu như sau:
Trong công nghiệp, kim loại nhôm (aluminium, Al) được sản xuất bằng phương pháp điện phân nóng chảy aluminium oxide. Biết hiệu suất của quá trình chuyên hóa Al2O3 thành Al là 95,4%. Để sản xuất 5,4 tân Al cân sử dụng bao nhiêu tân nguyên liệu Al2O3 (làm tròn đến hàng phần mười)?
Mạ điện là một trong những ứng dụng của điện phân dựa trên định luật Faraday. Sơ đồ bên dưới minh họa một bình điện phân được sử dụng để mạ bạc cho muỗng bằng đồng. Tính khối lượng kim loại bạc tạo thành phủ lên muỗng bằng đồng khi dùng dòng điện 2,1A trong 45 phút để mạ điện thìa đồng với hiệu suất là 80% (làm tròn đáp án đến hàng phần mười).
Trong công nghiệp, kim loại Mg được sản xuất từ quặng Carnallite \(\mathrm{KCl} . \mathrm{MgCl}_{2} . 6 \mathrm{H}_{2} \mathrm{O}\) bằng phương pháp điện phân nóng chảy \(\mathrm{MgCl}_{2}\) (đã được tách từ quặng). Quá trình điện phân diễn ra trong điều kiện không có không khí, với điện cực than chì. Ở cathode thu được kim loại Mg , còn ở anode chỉ sinh ra khí \(\mathrm{Cl}_{2}\). Giả sử khí \(\mathrm{Cl}_{2}\) thu được có thể tích là \(49,58 \mathrm{m}^{3}\) (ở đkc). Biết hiệu suất toàn bộ quá trình (từ quặng đến kim loại) là \(75 \%\). Tính khối lượng (kg) quặng đã dùng để sản xuất lượng Mg trên?
Cryolite (còn gọi là băng thạch) có công thức phân tử \(\mathrm{Na}_{3} \mathrm{AlF}_{6}\), được thêm vào \(\mathrm{Al}_{2} \mathrm{O}_{3}\) trong quá trình điện phân \(\mathrm{Al}_{2} \mathrm{O}_{3}\) nóng chảy để sản xuất aluminium. Cryolite không có tác dụng nào sau đây?
Cryolite là một chất được thêm vào trong quá trình điện phân nóng chảy quặng bauxide để sản xuất kim loại Al. Cryolite có công thức hóa học là
\(\mathrm{Al}_{2} \mathrm{O}_{3}\) có nhiệt độ nóng chảy rất cao \(\left(2050^{\circ} \mathrm{C}\right)\) nên việc điện phân nóng chảy \(\mathrm{Al}_{2} \mathrm{O}_{3}\) nguyên chất sẽ khó thực hiện. Hiện nay, theo công nghệ Hall-Héroult, người ta hoà tan \(\mathrm{Al}_{2} \mathrm{O}_{3}\) trong cryolite \(\left(\mathrm{Na}_{3} \mathrm{AlF}_{6}\right)\) nóng chảy được hỗn hợp chất điện phân có nhiệt độ nóng chảy thấp hơn (khoảng gần \(1000^{\circ} \mathrm{C}\) ). Giải pháp này giúp tiết kiệm năng lượng, đồng thời tạo ra chất lỏng có tính dẫn điện tốt, nhẹ hơn Al và nổi lên phía trên lớp A 1 lỏng, bảo vệ Al không bị oxi hoá bởi không khí. Sơ đồ thùng điện phân được biểu diễn như hình dưới:
Quá trình điện phân được tiến hành với dòng điện có hiệu điện thể thấp (khoảng 5 V ) và cường độ dòng điện \(100-300 \mathrm{~km}\). Để sản xuất được 1 tấn Al cần tiêu tốn khoảng 2 tấn \(\mathrm{Al}_{2} \mathrm{O}_{3} 50 \mathrm{~kg}\) cryolite, 400 kg than côc.
Cho biết: Năng lượng điện tiêu thụ theo lí thuyết, \(\mathrm{A}_{\mathrm{lt}}=\frac{\mathrm{U}_{\mathrm{m}} \cdot \mathrm{m} \cdot \mathrm{F}}{9 \cdot 3,6 \cdot 10^{6}}(\mathrm{kWh})\). Với \(\mathrm{m}_{\mathrm{Al}}\) là khối lượng Al được điều chế ( gam ); F là hằng số Faraday, \(\mathrm{F}=96485 \mathrm{C} \mathrm{mol}^{-1}, \mathrm{U}(\mathrm{V})\) là hiệu điện thế áp đặt vào hai cực của bình điện phân.
Một nhóm học sinh tìm hiểu quá trình thu hồi kim loại đồng. (copper) bằng phương pháp điện phân từ một đồng xu làm bằng hợp kim Cu - Zn chứa khoảng 95% đồng về khối lượng. Giả thuyết của nhóm học sinh là “khi điện phân, chỉ có tạp chất trong đồng xu tan hết vào trong dung dịch, còn lại sẽ là đồng tinh khiết”. Để kiểm tra giả thuyết này, nhóm học sinh đã thực hiện thí nghiệm như sau:
- Cân để xác định khối lượng ban đầu của đồng xu (2,23 gam) và thanh đồng tinh khiết (2,55 gam).
- Nối đồng xu với một điện cực và thanh đồng tinh khiết với điện cực còn lại của nguồn điện một chiều, rồi nhúng vào bình điện phân chứa dung địch copper(II) sulfate.
- Điện phân ở hiệu điện thế phù hợp.
- Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của đồng xu vả thanh đồng tinh khiết, thấy khối lượng đồng xu là 1,94 gam và khối lượng thanh đồng là m1 gam.
Điện phân dung dịch copper(II) sulfate bằng cặp điện cực Cu với cường độ dòng điện không đổi. Đồ thị nào sau đây biểu diễn sự thay đổi khối lượng của anode theo thời gian?
Hòa tan 4,5 gam tinh thể \(\mathrm{MSO}_{4} .5 \mathrm{H}_{2} \mathrm{O}\) vào nước thu được dung dịch X . Điện phân dung dịch X với điện cực trơ và cường độ dòng điện 1,93A. Nếu thời gian điện phân là \(\mathrm{t}(\mathrm{s})\) thì thu được kim loại M ở cathode và \(173,53 \mathrm{~mL}\) khí tại anode. Nếu thời gian điện phân là \(2 \mathrm{t}(\mathrm{s})\) thì thu được \(594,96 \mathrm{~mL}\) khí. Biết thể tích các khí đo ở đkc. Tính giá trị \(\mathrm{t}(\mathrm{s})\). Coi như quá trình điện phân tuân theo lý thuyết, bỏ qua sự thay đổi nhiệt độ và quá thế.















