Câu hỏi:
Điện phân dung dịch copper(II) sulfate bằng cặp điện cực Cu với cường độ dòng điện không đổi. Đồ thị nào sau đây biểu diễn sự thay đổi khối lượng của anode theo thời gian?
Đáp án đúng: C
Hiện tượng dương cực tan: nên khối lượng anode giảm dần theo thời gian.
Câu hỏi này thuộc đề thi trắc nghiệm dưới đây, bấm vào Bắt đầu thi để làm toàn bài
Tuyển Tập Đề Thi Tham Khảo Tốt Nghiệp THPT Năm 2025 – Hóa Học – Bộ Đề 02 là tài liệu ôn tập quan trọng dành cho học sinh lớp 12, giúp các em rèn luyện kỹ năng làm bài và chuẩn bị tốt nhất cho kỳ thi tốt nghiệp THPT 2025. Bộ đề được biên soạn theo định hướng của Bộ GD ĐT, bám sát chương trình học, bao gồm các chủ đề trọng tâm như phản ứng oxi hóa - khử, điện hóa học, este – chất béo, amino axit – protein, kim loại và phi kim… Hệ thống câu hỏi trắc nghiệm đa dạng, được thiết kế theo nhiều mức độ từ nhận biết, thông hiểu đến vận dụng và vận dụng cao, giúp học sinh làm quen với cấu trúc đề thi và phát triển tư duy hóa học. Mỗi đề thi đều có đáp án chi tiết và hướng dẫn giải cụ thể, hỗ trợ học sinh tự đánh giá năng lực, xác định điểm mạnh và cải thiện điểm yếu trong quá trình ôn tập.
Câu hỏi liên quan
Sodium carbonate (còn có tên gọi là washing soda) là hợp chất vô cơ có công thức phân tử là \(\mathrm{Na}_{2} \mathrm{CO}_{3}\). Sodium carbonate khan là chất bột màu trắng, hút ẩm và nóng chảy \(0^{\circ} 851^{\circ} \mathrm{C}\), dễ tan trong nước, Ở dưới 32,5 \({ }^{\circ} \mathrm{C}\), sodium carbonate kết tinh dạng \(\mathrm{Na}_{2} \mathrm{CO}_{3} \cdot \mathrm{nH}_{2} \mathrm{O}\). Cho các phát biểu sau về sodium carbonate:
Sodium carbonate được dùng trong công nghiệp nấu thủy tinh, ngoài ra có thể dùng làm mềm nước cứng
Cho biết ở nhiệt độ \(25^{\circ} \mathrm{C}\), hoà tan hết 76,75 gam \(\mathrm{Na}_{2} \mathrm{CO}_{3}\) trong 250 gam nước thì được dung dịch bão hoà. (làm tròn đáp án phần đơn vị và cho khối lượng riêng của H2O là 1g/mL)
Khác với \(\mathrm{NaHCO}_{3}\) (baking soda) dùng được trong nhà bếp thì \(\mathrm{Na}_{2} \mathrm{CO}_{3}\) không dùng trong ăn uống vì có tính ăn mòn cao
Cho m gam tinh thể \(\mathrm{Na}_{2} \mathrm{CO}_{3} \cdot \mathrm{nH}_{2} \mathrm{O}\) tác dụng vừa đủ với dung dịch \(\mathrm{BaCl}_{2} 5 \%\), thu được kết tủa X và dung dịch \(Y\) chỉ chứa một chất tan. Nồng độ chất tan trong dung dịch Y là \(2,7536 \%\). Công thức phân tử của tinh thể trên là \(\mathrm{Na}_{2} \mathrm{CO}_{3} .5 \mathrm{H}_{2} \mathrm{O}\)
a. Đúng theo SGK
b. Sai vì độ tan của \(\mathrm{Na}_{2} \mathrm{CO}_{3}\) là \(\frac{76,75}{250} \cdot 100=30,7 \approx 31\)
c. Đúng
d. Sai vì
Xét \(1 \mathrm{~mol} \mathrm{BaCl} l_{2}:\left\{\begin{array}{l}\mathrm{n}_{\mathrm{BaCO}_{3}}=1 \mathrm{~mol} \mathrm{n}_{\mathrm{Na}_{2} \mathrm{CO}_{3} \cdot \mathrm{nH}_{2} \mathrm{O}}=1 \mathrm{~mol}\end{array} \Rightarrow \mathrm{n}_{\mathrm{NaCl}}=2 \mathrm{n}_{\mathrm{Na}_{2} \mathrm{CO}_{3}}=2 \mathrm{~mol}\right.\)
Khối lượng dung dịch \(\mathrm{BaCl}_{2}: \mathrm{m}_{\mathrm{ddBaCl}_{2}}=\frac{208 \cdot 1}{5} \cdot 100=4160 \mathrm{gam}\)
BTKL dung dịch: \(\mathrm{m}_{\text {ddsau }}=4160+(106+18 \mathrm{n}) \cdot 1-197=4069+18 \mathrm{n}(\mathrm{gam})\)
Ta có: \(2,7536=\frac{2(23+35,5)}{4069+18 \mathrm{n}} \cdot 100 \Rightarrow \mathrm{n}=10\)
Poly(vinyl chloride) ( PVC ) là một chất dẻo có tính cách điện tốt, không thấm nước, bền với acid vì vậy nó được dùng để sản xuất vật liệu cách điện, ống dẫn nước, ...Khi đun nóng, PVC mềm ra rồi nóng chảy và khi để nguội nó lại đóng rắn. Hiện nay, trong công nghiệp sản xuất PVC người ta đi từ nguyên liệu là khí ethylene và chlorine. Quy trình sản xuất thực hiện theo sơ đồ khép kín như sau.
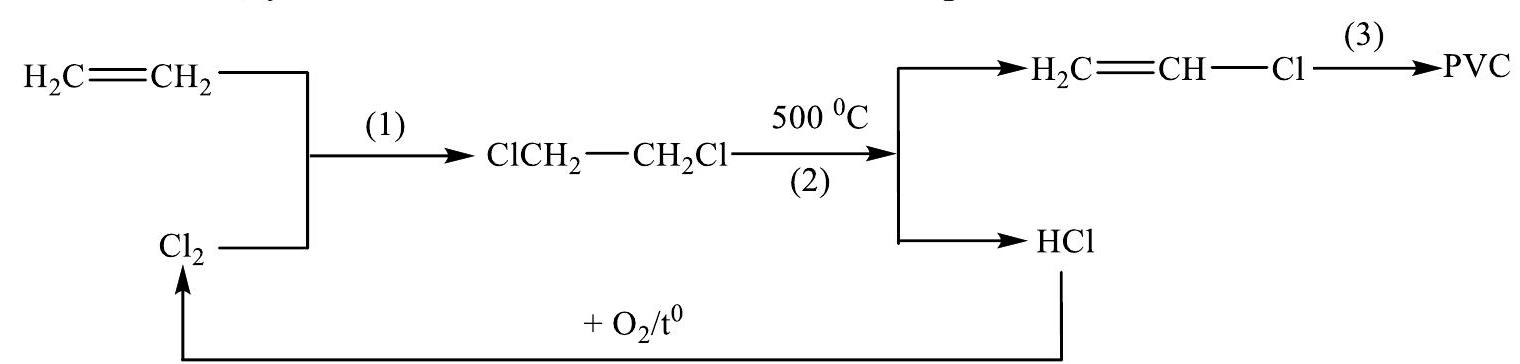
Phản ứng (4) giúp giảm thải khí gây ô nhiễm môi trường và tăng hiệu quả của quá trình sản xuất
Trong cơ chế phản ứng của phản ứng (1) thì giai đoạn đầu hình thành tiểu phân: \(\mathrm{CH}_{2}=\mathrm{CH} \bullet\)
PVC thuộc loại polymer nhiệt dẻo và vật liệu làm bằng PVC có thể tái chế
Biết chỉ có \(1,4 \%\) lượng chlorine bị thất thoát vì vậy để sản xuất 1 tấn PVC cần 576 kg chlorine (làm tròn đến phần nguyên)
a. Đúng vì giảm thiểu được lượng HCl thoát ra môi trường
b. Sai vì phản ứng là phản ứng cộng \(\mathrm{A}_{\mathrm{E}}\), giai đoạn 1 tạo carbocation chứ không tạo gốc tự do.
c. Đúng theo ĐN chất nhiệt dẻo.
d. Đúng vì ta có:
\(\mathrm{n}_{\mathrm{PVC}}=\frac{1 \cdot 10^{6}}{62,5} \Rightarrow \mathrm{n}_{\mathrm{Cl}_{2}}=\frac{10^{6}}{62,5} \Rightarrow \mathrm{~m}_{\mathrm{Cl}_{2}}=\frac{10^{6}}{62,5} \cdot 71=1136000 \mathrm{gam} \xrightarrow{\mathrm{H}=100-1,4-98,6 \%} \mathrm{~m}_{\mathrm{Cl}_{2}}=\frac{1136000}{98 \cdot 6 \%} \mathrm{gam}\)
Tuy nhiên theo sơ đồ trên thì sẽ có một lượng \(\mathrm{Cl}_{2}\) được tạo ra từ phản ứng (4).
Do đó khối lượng chlorine cần dùng là \(\frac{\frac{1136000}{98.6 \%}}{2}=576065 \mathrm{gam} \approx 576 \mathrm{~kg}\)
Xét 3 amino acid sau: glycine, alanine, valine. Cho các phát biểu:
Số nhóm amino và số nhóm carboxyl có trong một phân tử valine tương ứng là 2 và 1
Phân tử khối của alanine là 89
Từ ba amino acid: glycine, alanine, valine có thể tạo được tối đa 3 tripeptide chứa ba amino acid khác nhau
Dipeptide X (chứa 2 trong 3 gốc \(\alpha\)-amino acid trên). Khi phân tích nguyên tố \(\mathbf{X}\) thu được phần trăm khối lượng của các nguyên tố như sau: \(\% \mathrm{C}=41,10, \% \mathrm{H}=6,85, \% \mathrm{~N}=19,18\); còn lại là oxygen. Công thức cấu tạo của \(\mathbf{X}\) có thể là Gly-Ala hoặc Ala-Gly
a. Sai vì số nhóm amino và số nhóm carboxyl có trong một phân tử valine tương ứng là 1 và 1 .
b. Đúng vì Alanine có công thức là \(\mathrm{CH}_{3}-\mathrm{CH}\left(\mathrm{NH}_{2}\right)-\mathrm{COOH}\) có phân tử khối là 89
c. Sai vì tạo được tối đa 6 tripeptide chứa ba amino acid khác nhau.
d. Đúng vì từ phần trăm khối lượng nguyên tố và dipeptide (có thể có 2 N ) xác định được công thức phân tử của X là \(\mathrm{C}_{5} \mathrm{H}_{10} \mathrm{O}_{3} \mathrm{~N}_{2}\).
Vì X là dipeptide, nên X phải có 2 đơn vị \(\alpha\)-amino acid. Vậy các \(\alpha\)-amino acid phải là: \(\mathrm{H}_{2} \mathrm{NCH}_{2} \mathrm{COOH}\) và \(\mathrm{H}_{2} \mathrm{NCH}\left(\mathrm{CH}_{3}\right) \mathrm{COOH}\). Từ đó, dipeptide X có thể là là Gly- Ala hoặc Ala-gly.
Phèn sắt được sử dụng như là chất keo tụ trong quá trình xử lý nước (nước thải, nước giếng khoan...) do tạo chất kết tủa dạng keo kéo theo các chất bẩn lơ lửng trong nước lắng xuống. Phương trình thủy phân ion \(\mathrm{Fe}^{3+}\) được biểu diễn đơn giản như sau:
\(\begin{aligned} & \mathrm{Fe}^{3+}+6 \mathrm{H}_{2} \mathrm{O} \longrightarrow \text { phức chất } \mathrm{X} & \mathrm{X} \rightleftarrows \text { phức } \mathrm{Y}+3 \mathrm{H}^{+} \end{aligned}\)
Cho các phát biểu sau:
Phức chất X là phức bát diện có công thức phân tử là \(\left[\mathrm{Fe}\left(\mathrm{OH}_{2}\right)_{6}\right]^{3+}\)
Để bảo quản dung dịch muối \(\mathrm{FeCl}_{3}\) trong phòng thí nghiệm người ta thường nhỏ vài giọt dung dịch acid vào trong lọ đựng dung dịch muối
Dung dịch phèn sắt \(\mathrm{NH}_{4} \mathrm{Fe}\left(\mathrm{SO}_{4}\right)_{3} \cdot 12 \mathrm{H}_{2} \mathrm{O}\) có môi trường base
Phức \)Y\) có công thức là \(\left[\mathrm{Fe}(\mathrm{OH})_{2}\left(\mathrm{H}_{2} \mathrm{O}\right)_{3}\right]\)
a. Đúng
b. Đúng theo nguyên lí chuyển dịch cần bằng.
c. Sai vì phèn sắt cho môi trường acid theo phương trình sau:
1. \(\mathrm{NH}_{4} \mathrm{Fe}\left(\mathrm{SO}_{4}\right)_{2} \cdot 12 \mathrm{H}_{2} \mathrm{O} \longrightarrow \mathrm{NH}_{4}^{+}+\mathrm{Fe}^{3+}+2 \mathrm{SO}_{4}^{2-}+12 \mathrm{H}_{2} \mathrm{O}\)
2. \(\mathrm{Fe}^{3+}+\mathrm{H}_{2} \mathrm{O} \longrightarrow\left[\mathrm{Fe}\left(\mathrm{OH}_{2}\right)_{6}\right]^{3+}\)
3. \(\left[\mathrm{Fe}\left(\mathrm{OH}_{2}\right)_{6}\right]^{3+} \rightleftarrows\left[\mathrm{Fe}(\mathrm{OH})_{3}\left(\mathrm{H}_{2} \mathrm{O}\right)_{3}\right]+3 \mathrm{H}^{+}\)
riêng ion ammonium bị thủy phân tạo \(\mathrm{NH}_{3}\) thoát ra ngoài: \(\mathrm{NH}_{4}^{+}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{NH}_{3}+\mathrm{H}_{3} \mathrm{O}^{+}\)
d. Sai vì phương trình như sau: \(\left[\mathrm{Fe}\left(\mathrm{H}_{2} \mathrm{O}\right)_{6}\right]^{3+} \rightleftarrows\left[\mathrm{Fe}(\mathrm{OH})_{3}\left(\mathrm{H}_{2} \mathrm{O}\right)_{3}\right]+3 \mathrm{H}^{+}\)
0,35
Theo công thức đề cho ta có: \(\left\{\begin{array}{l}\mathrm{E}_{\mathrm{Sn}^{2+} / \mathrm{Sn}}=0,14+\frac{0,059}{2} \log (0,35)=0,13 \mathrm{~V} \\ \mathrm{E}_{\mathrm{Pb}^{2+} / \mathrm{Pb}}=-0,1265+\frac{0,059}{2} \log (0,001)=-0,215 \mathrm{~V}\end{array}\right.\)
Vì thế điện cực của \(\mathrm{Pb}^{2+} / \mathrm{Pb}\) âm hơn \(\mathrm{Sn}^{2+} / \mathrm{Sn}\) bên Sn đóng vai trò cathode, Pb đóng vai trò anode.
Do đó : \(\mathrm{E}_{\text {pin }}=\mathrm{E}_{\text {cathode }}-\mathrm{E}_{\text {anode }}=0,13-(-0,215)=0,345 \mathrm{~V} \approx 0,35 \mathrm{~V}\)

Trọn Bộ Giáo Án Word & PowerPoint Tiếng Anh 12 – I-Learn Smart World – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Tiếng Anh 12 – Global Success – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Hóa Học 12 – Kết Nối Tri Thức – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Hóa Học 12 – Chân Trời Sáng Tạo – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Công Nghệ 12 – Kết Nối Tri Thức – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Địa Lí 12 – Chân Trời Sáng Tạo – Năm Học 2025-2026
ĐĂNG KÝ GÓI THI VIP
- Truy cập hơn 100K đề thi thử và chính thức các năm
- 2M câu hỏi theo các mức độ: Nhận biết – Thông hiểu – Vận dụng
- Học nhanh với 10K Flashcard Tiếng Anh theo bộ sách và chủ đề
- Đầy đủ: Mầm non – Phổ thông (K12) – Đại học – Người đi làm
- Tải toàn bộ tài liệu trên TaiLieu.VN
- Loại bỏ quảng cáo để tăng khả năng tập trung ôn luyện
- Tặng 15 ngày khi đăng ký gói 3 tháng, 30 ngày với gói 6 tháng và 60 ngày với gói 12 tháng.