Chất nào sau đây là oxit axit?
Bộ Đề Thi Thử Tốt nghiệp THPT môn Hóa học năm 2025 - Đề thi thử Tốt nghiệp THPT môn Hóa học năm 2023
Đề thi thử Tốt nghiệp THPT môn Hóa học năm 2025 không chỉ giúp học sinh củng cố kiến thức đã học mà còn rèn luyện khả năng tư duy logic và giải quyết vấn đề nhanh chóng, chính xác. Đề thi bao gồm các dạng bài tập đa dạng để các em chuẩn bị tốt cho kỳ thi khác.
Câu hỏi liên quan
Quá trình sản xuất soda bằng phương pháp Solvay không sử dụng nguyên liệu nào sau đây?
Kim loại X tác dung với \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng cho khí \(\mathrm{H}_{2}\). Mặt khác oxide của X bị khí \(\mathrm{H}_{2}\) khử thành kim loại ở nhiệt độ cao. X là kim loại nào sau đây?
Chất nào sau đây tác dụng với Fe , tạo thành iron(II) bromide?
Để kiểm tra sự có mặt của một số cation kim loại có trong dung dịch ta tiến hành thí nghiệm sau: Cho khoảng 4-6 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 1 mL dung dịch cần xác định cation trong muối, thấy có kết tủa màu nâu đỏ xuất hiện ngay. Trong dung dịch này chứa cation nào sau đây?
Cho sơ đồ sau: \(\mathrm{Fe} \xrightarrow{+\mathrm{Cl}_{2}, \mathrm{t}^{0}} \mathrm{~A} \xrightarrow{+\mathrm{KOH}} \mathrm{B} \xrightarrow{+\mathrm{t}^{0}} \mathrm{X}\) . Chất X là
Trong vỏ Trái Đất, kim loại nào sau đây có thể tồn tại ở dạng đơn chất?
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Dùng pipette hút chính xác \(5,00 \mathrm{mL}\) dung dịch \(\mathrm{FeSO}_{4}\) nồng độ a M cho vào bình định mức loại 50 mL. Thêm tiếp nước cất và định mức đến vạch, thu được 50 mL dung dịch Y.
Bước 2: Chuẩn độ \(10,00 \mathrm{mL}\) dung dịch Y trong môi trường \(\mathrm{H}_{2} \mathrm{SO}_{4}\) loãng cần vừa đủ \(8,50 \mathrm{mL}\) dung dịch \(\mathrm{KMnO}_{4}\ 0,02 \mathrm{M}\).
Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần trăm).
Khi nung nóng, các muối ngậm nước sẽ mất dần khối lượng. Sự giảm khối lượng muối \(\mathrm{Al}\left(\mathrm{NO}_{3}\right)_{3}.9 \mathrm{H}_{2} \mathrm{O}\) theo nhiệt độ được biểu diễn bởi giản đồ sau:
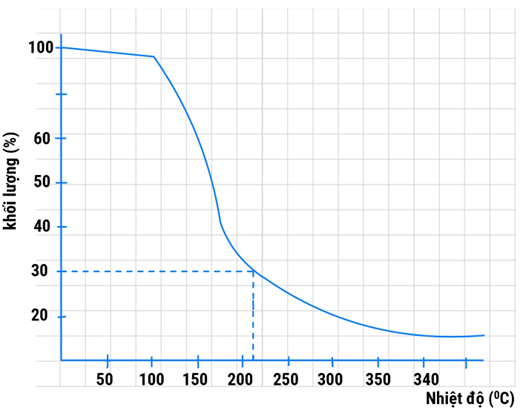
Biết rằng, khi tăng nhiệt độ, \(\mathrm{H}_{2} \mathrm{O}\) tách ra trước, sau đó đến phản ứng nhiệt phân muối khan. Tại nhiệt độ \(210^{\circ} \mathrm{C}\), phần rắn còn lại (chứa ba nguyên tố). Tính thành phần \% theo khối lượng của oxygen có trong phần chất rắn tại \(210^{\circ} \mathrm{C}\). (làm tròn đáp án đến hàng phần mười)
Phèn chua có công thức hóa học: \(\mathrm{K}_{2} \mathrm{SO}_{4} . \mathrm{X}_{2}\left(\mathrm{SO}_{4}\right)_{3} . 24 \mathrm{H}_{2} \mathrm{O}\). Kim loại X là
Các khoáng chất \(Y_{1}, Y_{2}\) và \(Y_{3}\) là các tinh thể trong suốt, không hút ẩm, đều là muối ngậm nước của cùng một kim loại hóa trị II và một gốc acid. Khi nung đến trên \(200^{\circ} \mathrm{C}\), tất cả chúng đều chuyển thành chất \(Z\), cũng tồn tại ở dạng khoáng tự nhiên. Khi hòa tan 10 gam \(\mathrm{Y}_{1}\) và 10 gam \(\mathrm{Y}_{3}\) vào 100 gam nước, thu được dung dịch \(Z\) có nồng độ \(10 \%\). Hòa tan từ từ 26,75 gam \(Y_{2}\) theo từng lượng nhỏ vào 100 gam nước tạo thành dung dịch bão hòa \(Z\) ở \(25^{\circ} \mathrm{C}\), khi trộn lẫn dung dịch này với dung dịch \(\mathrm{BaCl}_{2}\) dư thu được 29,125 gam kết tủa trắng muối sulfate. Bằng cách đun cẩn thận \(Y_{1}\) đến \(63^{\circ} \mathrm{C}\) có thể thu được \(Y_{2}\), khối lượng bã rắn sau khi nung chỉ còn lại \(85,60 \%\) so với ban đầu. Tổng số phân tử H2O trong công thức tinh thể của 3 loại tinh trên là bao nhiêu?
Cho 11,6 gam Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam hỗn hợp kim loại. Giá trị của m là
Kim loại \(M\) phản ứng được với: dung dịch HCl , dung dịch \(\mathrm{Cu}\left(\mathrm{NO}_{3}\right)_{2}\), dung dịch \(\mathrm{HNO}_{3}\) (đặc, nguội). Kim loại M là
A là tinh thể muối chloride kép ngậm nước của Mg và một kim loại kiềm, được hình thành từ quá trình bốc hơi nước biển. Để xác định công thức của A , người ta tiến hành hai thí nghiệm sau:
Thí nghiệm 1: Hoà tan hết 1,110 gam A vào nước thu dung dịch B , cho B tác dụng với lượng dư dung dịch \(\mathrm{AgNO}_{3}\) thì thu được 1,722 gam kết tủa trắng.
Thí nghiệm 2: Nung 1,665 gam A đến khối lượng không đổi thu được chất rắn C có khối lượng giảm \(38,92 \%\) so với khối lượng A ban đầu. Cho C tác dụng với lượng dư dung dịch NaOH thu được kết tủa D. Lọc lấy kết tủa, rửa sạch rồi đem nung trong không khí đến khối lượng không đổi, thu được 0,24 gam chất rắn E (coi các phản ứng xảy ra hoàn toàn).
Tổng số nguyên tử có trong A là bao nhiêu?
Tiến hành thí nghiệm sau:
Bước 1: Cho lần lượt 2 mL mỗi dung dịch \(\mathrm{CaCl}_{2}\ 1 \mathrm{M}, \mathrm{BaCl}_{2}\ 1 \mathrm{M}\) và \(\mathrm{Na}_{2} \mathrm{SO}_{4}\ 1 \mathrm{M}\) vào các ống nghiệm tương ứng (1), (2), (3).
Bước 2: Thêm từ từ từng giọt 2 mL dung dịch \(\mathrm{Na}_{2} \mathrm{SO}_{4}\ 1 \mathrm{M}\) vào ống nghiệm (1) và (2).
Bước 3: Thêm từ từ từng giọt 2 mL dung dịch \(\mathrm{BaCl}_{2}\ 1 \mathrm{M}\) vào ống (3).
Chất nào sau đây tác dụng với dung dịch \(\mathrm{NaHCO}_{3}\) sinh ra khí \(\mathrm{CO}_{2}\)?
Để khám phá tính chất của Cu, người ta tiến hành thì nghiệm sau đây:
Thí nghiệm 1: Lấy một lượng bột đồng thích hợp cho vào ống nghiệm chứa dung dịch \(\mathrm{FeCl}_{3}\) màu vàng nâu \(0,1 \mathrm{M}\). Sau khi phản ứng xảy ra, dung dịch chuyển sang màu xanh, cho thấy \(\mathrm{CuCl}_{2}\) được tạo thành. Sau 2 ngày, dung dịch chuyển sang màu xanh nhạt và xuất hiện kết tủa màu trắng. Sau khi kiểm tra, thấy kết tủa màu trắng là CuCl.
Thí nghiệm 2: Cho dung dịch màu xanh lam trong suốt ở thí nghiệm 1 vào ống nghiệm, nhỏ dung dịch KSCN \(0,10 \mathrm{M}\) vào ống nghiệm, dung dịch lập tức chuyển sang màu đỏ và xuất hiện kết tủa màu trắng. Lắc ống nghiệm, màu đỏ dần mất đi và kết tủa trắng tăng lên. Sau khi thử nghiệm, người ta phát hiện kết tủa màu trắng đó chính là CuSCN.
Thí nghiệm 3: Nhỏ dung dịch \(\mathrm{KSCN} 0,10 \mathrm{M}\) vào ống nghiệm chứa 2 mL dung dịch \(\mathrm{CuSO}_{4} 0,1 \mathrm{M}\), không thấy có kết tủa trắng xuất hiện.
Cho biết rằng CuCl và CuSCN đều là chất rắn màu trắng, ít tan trong nưởc. Cho các phát biểu sau:
Khi nhiệt kế y tế thủy ngân bị vỡ sẽ làm thuỷ ngân phát tán ra không khí. Nếu hít hơi thủy ngân vào có thể gây viêm phổi nặng, mất trí nhớ, lơ mơ, co giật, nôn ói, viêm ruột,... Trong phòng thí nghiệm, người ta sử dụng chất nào dưới đây để thu hồi thủy ngân?
Dolomite là một trong những thành phần không thể thiếu được trong lĩnh vực chăn nuôi thủy sản, đặc biệt là nuôi tôm. Thành phần chính của dolomite bao gồm muối calcium carbonate và muối X. Tên gọi của muối X là
Phần trăm khối lượng của Al có trong alminium hydroxide là
Hai kim loại \(X, Y\) và dung dịch muối chloride của chúng có các phản ứng hóa học sau:
Phát biểu nào sau đây là đúng ?















