Câu hỏi:
Cho quá trình phản ứng dưới dạng hình ảnh như sau:
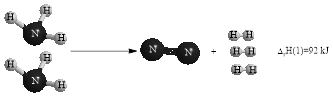
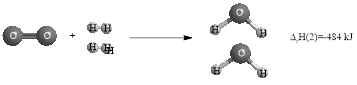
Các chất trong hình đều ở trạng thái khí.
Hãy tính biến thiên enthalpy của phản ứng sau đây: \(2 \mathrm{N}_{2(\mathrm{g})}+6 \mathrm{H}_{2} \mathrm{O}_{(\mathrm{g})} \longrightarrow 3 \mathrm{O}_{2(\mathrm{g})}+4 \mathrm{NH}_{3(\mathrm{g})} \Delta_{\mathrm{r}} \mathrm{H}(3)\)
Đáp án đúng: 1268
Từ mô hình ta có các phương trình xảy ra: \(\begin{cases}2 \mathrm{NH}_{3(\mathrm{g})} \longrightarrow \mathrm{N}_{2(\mathrm{g})}+3 \mathrm{H}_{2(\mathrm{g})} & \Delta_{\mathrm{r}} \mathrm{H}(1)=92 \mathrm{kJ} \\ \mathrm{O}_{2(\mathrm{g})}+2 \mathrm{H}_{2(\mathrm{g})} \longrightarrow 2 \mathrm{H}_{2} \mathrm{O}_{(\mathrm{g})} & \Delta_{\mathrm{r}} \mathrm{H}(2)=-484 \mathrm{kJ}\end{cases}\)
Theo ĐL Hess ta có: \(\Delta_{\mathrm{r}} \mathrm{H}(3)=-2 \Delta_{\mathrm{r}} \mathrm{H}(1)-3 \Delta_{\mathrm{r}} \mathrm{H}(2)=-2(92)-3(-484)=1268 \mathrm{kJ}\).
Câu hỏi này thuộc đề thi trắc nghiệm dưới đây, bấm vào Bắt đầu thi để làm toàn bài
Tuyển Tập Đề Thi Tham Khảo Tốt Nghiệp THPT Năm 2025 - Hóa Học - Bộ Đề 05 được biên soạn theo định hướng mới nhất của kỳ thi tốt nghiệp THPT. Mỗi đề đều có cấu trúc ba phần: trắc nghiệm nhiều lựa chọn, trắc nghiệm đúng – sai, và trắc nghiệm trả lời ngắn, kết hợp cùng hệ thống câu hỏi đa dạng, phân hóa rõ rệt theo các mức độ nhận thức từ cơ bản đến nâng cao. Điểm nổi bật của bộ đề là các câu hỏi bám sát thực tế giảng dạy, đề cập đến nhiều chủ đề quen thuộc như hợp chất hữu cơ, amino acid – protein, ester, polymer, ăn mòn kim loại, phản ứng điện hóa, cân bằng hóa học, chất điện li và môi trường. Mỗi đề đều có đáp án và hướng dẫn giải chi tiết, giúp học sinh tự ôn tập, rèn kỹ năng giải nhanh và nắm vững bản chất kiến thức. Đây là tài liệu ôn luyện lý tưởng giúp học sinh lớp 12 hệ thống hóa kiến thức toàn diện và sẵn sàng bước vào kỳ thi quan trọng với sự tự tin cao nhất.
Câu hỏi liên quan

Trọn Bộ Giáo Án Word & PowerPoint Tiếng Anh 12 – I-Learn Smart World – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Tiếng Anh 12 – Global Success – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Hóa Học 12 – Kết Nối Tri Thức – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Hóa Học 12 – Chân Trời Sáng Tạo – Năm Học 2025-2026

Trọn Bộ Giáo Án Word & PowerPoint Công Nghệ 12 – Kết Nối Tri Thức – Năm Học 2025-2026

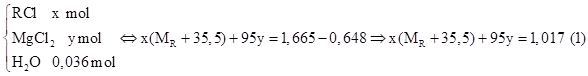
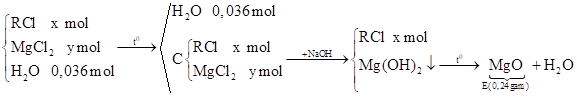 Ta có: \(\mathrm{n}_{\mathrm{MgO}}=\frac{0,24}{40}=0,006 \mathrm{mol} \Rightarrow \mathrm{n}_{\mathrm{MgCl}_{2}}=\mathrm{y}=0,006 \mathrm{mol}\)
Ta có: \(\mathrm{n}_{\mathrm{MgO}}=\frac{0,24}{40}=0,006 \mathrm{mol} \Rightarrow \mathrm{n}_{\mathrm{MgCl}_{2}}=\mathrm{y}=0,006 \mathrm{mol}\)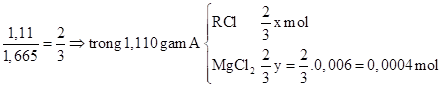 Ta có: \(\mathrm{n}_{\mathrm{AgCl}}=\frac{1,722}{143,5}=0,012 \mathrm{mol} \xrightarrow{\text { BTNTCl }} \frac{2}{3} \mathrm{x}+2.0,004=0,012 \Rightarrow \mathrm{x}=0,006\)
Ta có: \(\mathrm{n}_{\mathrm{AgCl}}=\frac{1,722}{143,5}=0,012 \mathrm{mol} \xrightarrow{\text { BTNTCl }} \frac{2}{3} \mathrm{x}+2.0,004=0,012 \Rightarrow \mathrm{x}=0,006\)